
科目: 来源: 题型:
| A、2n(C)+2+n(N) | B、2n(C)+2+2n(N) | C、2n(C)+2 | D、2n(C)+1+2n(N) |
查看答案和解析>>
科目: 来源: 题型:
| A、3mol | B、4mol | C、5mol | D、6mol |
查看答案和解析>>
科目: 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目: 来源: 题型:
| A、HClO4 | B、H2SeO3 | C、H3BO3 | D、H3PO4 |
查看答案和解析>>
科目: 来源: 题型:
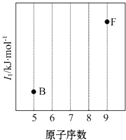 (1)依据第2周期元素第一电离能的变化规律,参照如图中B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置.
(1)依据第2周期元素第一电离能的变化规律,参照如图中B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置.查看答案和解析>>
科目: 来源: 题型:
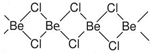 锂和铍单质及化合物的性质具有特殊性.
锂和铍单质及化合物的性质具有特殊性.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 电离能/(kJ?mol-1) | I1 | I2 | I3 | I4 | I5 |
| Y | 584 | 1823 | 2751 | 11584 | 14837 |
查看答案和解析>>
科目: 来源: 题型:
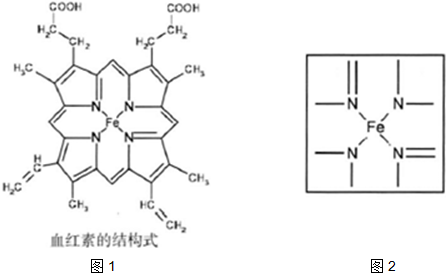
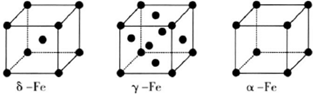
查看答案和解析>>
科目: 来源: 题型:
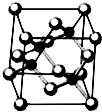 Ⅰ.砷化镓为第三代半导体,以其为材料制造的灯泡寿命长.耗能少.已知砷化镓的晶胞结构如图所示.请回答下列问题:
Ⅰ.砷化镓为第三代半导体,以其为材料制造的灯泡寿命长.耗能少.已知砷化镓的晶胞结构如图所示.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com