
科目: 来源: 题型:
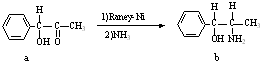
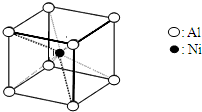
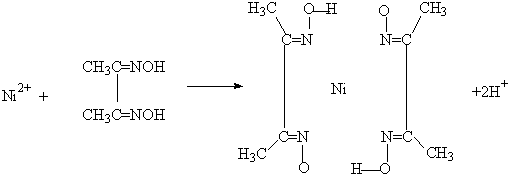
查看答案和解析>>
科目: 来源: 题型:
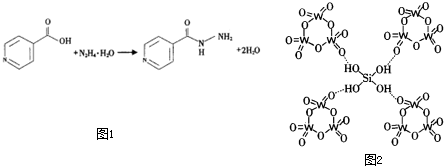
查看答案和解析>>
科目: 来源: 题型:
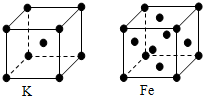
查看答案和解析>>
科目: 来源: 题型:
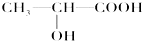
查看答案和解析>>
科目: 来源: 题型:
| 分子式 | 结构简式 | 外观 | 熔点 | 溶解性 |
| C12H10ClN3O | 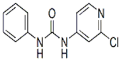 |
白色结晶粉末 | 170~172°C | 易溶于水 |
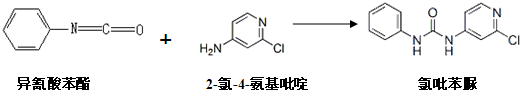
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
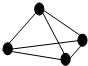 最近意大利罗马大学的科学家获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
最近意大利罗马大学的科学家获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )| A、1 mol N4气体转变为N2将放出882 kJ热量 | B、N4分子中N为sp2杂化 | C、N4与N2互称为同位素 | D、N4沸点比P4(白磷)高 |
查看答案和解析>>
科目: 来源: 题型:
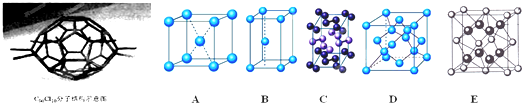
| A、C70的熔点比石墨的熔点低 | B、C70分子中的碳原子的杂化方式与碳酸中的碳原子相同 | C、C70分子中含有70个σ键,35个π键 | D、C70Cl10分子中共用电子对数目为145个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com