
科目: 来源: 题型:
| A、NaCl晶体和晶体NaF的晶格能 | B、等物质的量的CO2分子和分子CH2=CH2中δ键的数目 | C、等物质的量的SO2和O2在一定条件下反应,SO2与O2的转化率 | D、25℃时pH=11的NaOH溶液和pH=11的Na2CO3溶液中的H+的浓度 |
查看答案和解析>>
科目: 来源: 题型:
 通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
| ||
查看答案和解析>>
科目: 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目: 来源: 题型:
| A、晶格能由大到小:NaI>NaBr>NaCl>NaF | B、含阳离子的化合物一定有阴离子 | C、含有共价键的晶体一定具有高的熔、沸点及硬度 | D、空间利用率:面心立方>六方密堆积>体心立方 |
查看答案和解析>>
科目: 来源: 题型:
| A、离子晶体的晶格能:MgO>KCl>NaCl | B、蔗糖在人体内水解的产物只有葡萄糖 | C、对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 | D、对羟基苯甲醛的沸点大于邻羟基苯甲醛,原因是后者分子之间存在氢键 |
查看答案和解析>>
科目: 来源: 题型:
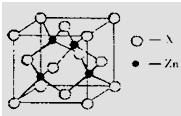 Zn和Al都具有两性,其单质和化合物在建筑业、电子工业和石油化工等方面应用广泛.请回答下列问题:
Zn和Al都具有两性,其单质和化合物在建筑业、电子工业和石油化工等方面应用广泛.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com