
科目: 来源: 题型:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| A、该反应的焓变为△H<0 |
| B、830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积.平衡向逆反应方向移动 |
| C、若1200℃时,某时刻体系中CO2、H2、CO、H2O的浓度分别为2 mol?L-1、2 mol?L-1、4 mol?L-1、4 mol?L-1,则此时v逆<v正 |
| D、若 830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,CO转化率为83.3% |
查看答案和解析>>
科目: 来源: 题型:
| c(x)?c2(y) |
| c3(z)?c2(w) |
| A、升高温度,该反应平衡常数K的变化无法判断 |
| B、增大压强,W的质量分数减小 |
| C、该反应的化学方程式为:2z(g)+2w(g)?x(g)+2y(g) |
| D、增大X气体浓度平衡向正反应方向移动 |
查看答案和解析>>
科目: 来源: 题型:
| 1 |
| 3 |
| 2 |
| 3 |
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
| A、△H<0 | ||
B、该反应的平衡常数表达式是K=
| ||
| C、其他条件不变,向平衡体系充入CO2气体,K值减小 | ||
| D、其他条件不变,升高温度,可以降低CO的平衡转化率 |
查看答案和解析>>
科目: 来源: 题型:
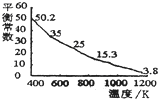 碘单质难溶于小却易溶于KI溶液.碘水中加入KI溶液发生反应:I2(aq)+I-(aq)?I3-(aq),该反应的平衡常数与温度的关系如图,下列说法不正确的是( )
碘单质难溶于小却易溶于KI溶液.碘水中加入KI溶液发生反应:I2(aq)+I-(aq)?I3-(aq),该反应的平衡常数与温度的关系如图,下列说法不正确的是( )| A、上述正反应为放热反应 | B、上述体系中加入苯,平衡不移动 | C、可运用该反应原理除去硫粉中少量的碘单质 | D、实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液 |
查看答案和解析>>
科目: 来源: 题型:
| 化学方程式 | K (t1) | K (t2) |
| F2+H2?2HF | 1.8×1036 | 1.9×1032 |
| Cl2+H2?2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2?2HBr | 5.6×107 | 9.3×106 |
| I2+H2?2HI | 43 | 34 |
| A、X2与H2反应的剧烈程度逐渐减弱 |
| B、HX的稳定性逐渐减弱 |
| C、HX的生成反应是放热反应 |
| D、在相同条件下,平衡时X2的转化率逐渐降低 |
查看答案和解析>>
科目: 来源: 题型:
| A、化学平衡发生移动,平衡常数不一定发生变化 | B、升高温度会增大化学反应速率,其原困是增加了活化分子的百分数 | C、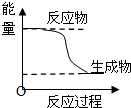 某化学反应的能量变化如图所示,则该反应的△H>0.△S>0 | D、H3PO4的电离常数:Kal>>Ka2>>Ka3 |
查看答案和解析>>
科目: 来源: 题型:
| A、CO与HbO2反应的平衡常数K=[O2]?[HbCO]/[CO]?[HbO2] | B、人体吸入的CO越多,与血红蛋白结合的O2越少 | C、若吸入的CO与O2浓度之比等于0.001时,人的智力会受损 | D、把CO中毒病人放入高压氧仓中解毒,目的是:使平衡常数减小,且向逆移动 |
查看答案和解析>>
科目: 来源: 题型:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(累计值) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目: 来源: 题型:
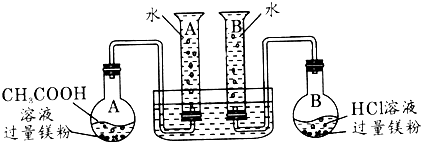
| A烧瓶中 | B烧瓶中 | 20℃、101kPa量筒(50ml)内气体体积 | 反应时间 | |
| A瓶 | B瓶 | |||
| 40ml0.1mol/L CH3COOH溶液 |
40ml0.1mol/L 盐酸溶液 |
5ml | t(a1)=155s | t(b1)=7s |
| 10ml | t(a2)=310s | t(b2)=16s | ||
| 15ml | t(a3)=465s | t(b3)=30s | ||
| 20ml | t(a4)=665s | t(b4)=34s | ||
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 10%H2O2的体积/mL | 5.0 | 5.0 | V1 | V2 |
| 20%硫酸的体积/mL | 0 | 0.5 | 1.0 | V3 |
| 水的体积/mL | 15 | 14.5 | V4 | 13.5 |
| 所需时间t/s | t1 | t2 | t3 | t4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com