
科目: 来源: 题型:
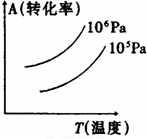 有一化学平衡mA(g)+nB(g)?PC(g)+qD(g),右图表示A的转化率与压强、温度的关系.由此得出的正确结论是( )
有一化学平衡mA(g)+nB(g)?PC(g)+qD(g),右图表示A的转化率与压强、温度的关系.由此得出的正确结论是( )| A、正反应是吸热反应 | B、(m+n)<(p+q) | C、压强增大,A的转化率减小 | D、温度升高,A的转化率减小 |
查看答案和解析>>
科目: 来源: 题型:
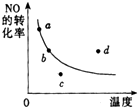 2NO+O2?2NO2是放热反应.右图表示其他条件一定时,反应
2NO+O2?2NO2是放热反应.右图表示其他条件一定时,反应| A、a点 | B、b点 | C、c点 | D、d点 |
查看答案和解析>>
科目: 来源: 题型:
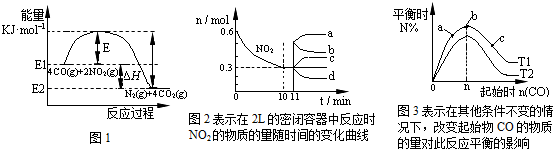
| A、在一定温度、固定容积的密闭容器里,混合气体的密度不再改变可以说明上述可逆反应已达平衡 | B、由图1可得加入适当的催化剂,E和△H都减小 | C、图2中0~10min内该反应的平均速率v(CO)=0.03mol?L-1?min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(NO2)的变化曲线为d | D、图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2 |
查看答案和解析>>
科目: 来源: 题型:
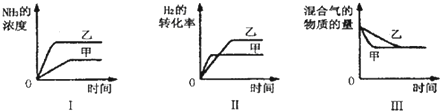
| A、图I研究的是温度对反应的影响,且甲的温度比乙高 | B、图Ⅱ研究的是压强对反应的影响,且甲的压强比乙大 | C、图Ⅱ研究的是温度对反应的影响,且甲的温度比乙高 | D、图Ⅲ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率比甲高 |
查看答案和解析>>
科目: 来源: 题型:
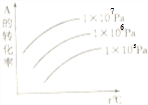
| A、m+n<p+q;Q>0 | B、m+n>p+q;Q>0 | C、m+n<p+q;Q<0 | D、m+n>p+q;Q<0 |
查看答案和解析>>
科目: 来源: 题型:
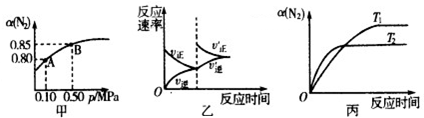
| A、由图甲知,A点N2的平衡浓度为0.2mol?L-1 | B、由图甲知,B点N2、H2、NH3的平衡浓度之比为1:3:2 | C、达到平衡后,缩小容器体积,则反应速率变化图象可以用图乙表示 | D、压强为0.5MPa时,在不同温度下N2的转化率与温度的关系如图丙,则T1<T2 |
查看答案和解析>>
科目: 来源: 题型:
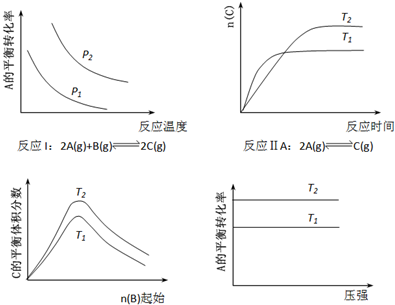
| A、反应Ⅰ:△H>0,P2>P1 | B、反应Ⅱ:△H<0,T1<T2 | C、反应Ⅲ:△H>0,T2>T1或△H<0,T2<T1 | D、反应Ⅳ:△H<0,T2>T1 |
查看答案和解析>>
科目: 来源: 题型:
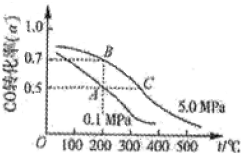 密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示.下列说法正确的是( )
密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示.下列说法正确的是( )| A、若A、B两点表示在某时刻达到的平衡状态,则A、B两点时容器内总气体的物质的量,n(A):n(B)=4:5 | B、若A、C两点都表示已达到的平衡状态,则从反应开始至到达平衡状态所需的时间tA>tC | C、设B、C两点的平衡常数分别为KB、KC,则KB<KC | D、在不改变反应物用量的情况下,采取降温、减压或将甲醇从混合体系中分离出来均可提高CO的转化率 |
查看答案和解析>>
科目: 来源: 题型:
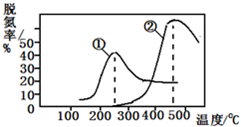 工业上采用NH3作还原剂脱氮原理为:NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O(g),烟气以一定的流速通过,测量不同温度下逸出气体中氮氧化物含量,从而确定烟气效率,如图是两种不同催化剂的脱氮效率曲线,判断以下分析正确的是( )
工业上采用NH3作还原剂脱氮原理为:NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O(g),烟气以一定的流速通过,测量不同温度下逸出气体中氮氧化物含量,从而确定烟气效率,如图是两种不同催化剂的脱氮效率曲线,判断以下分析正确的是( )| A、上述反应的正反应为吸热反应 | B、催化剂①、②分别适合于250℃和450℃左右脱氮 | C、曲线①、②最高点表示此时平衡转化率最高 | D、相同条件下,改变压强对脱氮率没有影响 |
查看答案和解析>>
科目: 来源: 题型:
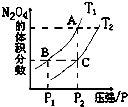 (1)反应2NO2(g)?N2O4(g)△H<0,在温度为T1、T2时,平衡体系N2O4的体积分数随压强变化曲线如图所示.则T1
(1)反应2NO2(g)?N2O4(g)△H<0,在温度为T1、T2时,平衡体系N2O4的体积分数随压强变化曲线如图所示.则T1查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com