
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:阅读理解
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 | 2.0 |
| 3 |
| 2 |
| 4 |
| 7 |
查看答案和解析>>
科目: 来源: 题型:
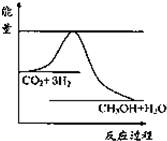 (1)一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.关于该反应的下列说法中,正确的是
(1)一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.关于该反应的下列说法中,正确的是查看答案和解析>>
科目: 来源: 题型:
| A、反应物分子间的碰撞一定能发生化学反应 | B、X(g)+2Y(g)?2Z(g)△H<0,反应达平衡后缩小容器体积,X浓度变小 | C、反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 | D、反应2A(g)+B(g)?3C(g)△H>0,在一定体积的密闭容器中达平衡后,加入B,反应的△H增大 |
查看答案和解析>>
科目: 来源: 题型:
| A、焓变大于零的反应一定不能自发进行 | B、熵判据可作为判断反应进行方向的唯一判据 | C、综合考虑焓判据和熵判据的复合判据,更适用于所有的过程 | D、根据过程的自发性,不仅能判断过程的方向,也能确定过程是否一定会发生和过程发生的速率 |
查看答案和解析>>
科目: 来源: 题型:
| A、焓变和熵变都大于0的反应肯定是自发 | B、一个化学反应的自发性与该反应的化学反应速率无关 | C、自发反应都可以用于原电池的设计 | D、在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com