
科目: 来源:2013-2014学年高考化学二轮专题复习 化学实验常用仪器和基本操作练习卷(解析版) 题型:实验题
浅绿色的硫酸亚铁铵晶体[又名莫尔盐,(NH4)2SO4·FeSO4·6H2O]比绿矾(FeSO4·7H2O)更稳定,常用于定量分析。莫尔盐的一种实验室制法如下:
废铁屑
 溶液A
溶液A
 莫尔盐
莫尔盐
(1)向废铁屑中加入稀硫酸后,不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是 ;证明溶液A不含Fe3+的最佳试剂是 (填序号字母)。
A.酚酞溶液B.KSCN溶液
C.烧碱溶液D.KMnO4溶液
操作Ⅰ的步骤是:加热蒸发、 、过滤。
(2)操作Ⅰ得到的莫尔盐晶体用少量乙醇淋洗,其目的是:①除去晶体表面附着的硫酸、水等杂质;② 。
(3)用托盘天平称量(NH4)2SO4晶体,晶体要放在天平 (填“左”或“右”)盘。
(4)从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a接 ; 接 。

将装置C中两种液体分离开的操作名称是 。装置D的作用是 。
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮专题复习 化学常用计量练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,则下列说法中正确的是( )
A.常温下,0.1 mol碳酸钠晶体中含有C 的个数为0.1NA
的个数为0.1NA
B.标准状况下22.4 L H2O所含分子数为NA
C.1 L 0.5 mol·L-1 CH3COOH溶液中,CH3COO-的个数为0.5NA
D.在NO、NO2的混合气体22.4 L中,含有的氮原子数为NA个
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮专题复习 化学常用计量练习卷(解析版) 题型:选择题
在标准状况下①6.72 L CH4
②3.01×1023个HCl分子 ③13.6 g H2S
④0.2 mol NH3
下列对这四种气体的关系从大到小表达正确的是( )
a.体积②>③>①>④
b.密度②>③>④>①
c.质量②>③>①>④
d.氢原子个数①>③>④>②
A.abcB.bcdC.acdD.abcd
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮专题复习 化学常用计量练习卷(解析版) 题型:选择题
设阿伏加德罗常数的数值用NA表示,下列叙述中正确的是( )
①在反应KIO3+6HI KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA
KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA
②35.5 g Cl2中含有共价键数为NA
③0.44 g C3H8中含有的共价键总数目为0.1NA
④24 g镁的原子中最外层电子数为NA
⑤6.4 g的S2和S8混合物中,含硫原子总数为0.2NA
⑥在常温常压下,1 mol甲烷分子所含质子数为10NA
⑦1 mol冰醋酸与1 mol乙醇在加热和浓硫酸存在条件下充分反应生成的水分子数为NA
A.③⑤⑥B.②③④⑤C.②④⑥⑦D.①②③④
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮专题复习 化学常用计量练习卷(解析版) 题型:选择题
设NA代表阿伏加德罗常数的数值。已知C2H4和C3H6的混合物的质量为a g,则该混合物( )
A.所含共用电子对数目为( +1)NA
+1)NA
B.所含碳氢键数目为 NA
NA
C.燃烧时消耗的O2一定是 L
L
D.所含原子总数为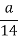 NA
NA
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮专题复习 化学常用计量练习卷(解析版) 题型:选择题
在200 mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子。则该硫酸盐的物质的量浓度为( )
A.2 mol·L-1B.2.5 mol·L-1C.5 mol·L-1D.7.5 mol·L-1
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮专题复习 化学常用计量练习卷(解析版) 题型:选择题
下列有关化学实验的描述中正确的是( )
A.将40 g NaOH溶于1 L蒸馏水中,该溶液的物质的量浓度为1 mol·L-1
B.配制一定物质的量浓度的NaCl溶液,如果NaCl固体中含有Na2CO3,所配制溶液中c(Na+)将偏低
C.将2.5 g CuSO4·5H2O溶解在97.5 g水中,配制质量分数为2.5%的CuSO4溶液
D.把200 mL 3 mol·L-1的BaCl2溶液跟100 mL 3 mol·L-1的KCl溶液混合后,溶液中c(Cl-)=5 mol·L-1
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮专题复习 化学常用计量练习卷(解析版) 题型:选择题
将18 g铜和铁的混合物投入200 mL稀硝酸中,充分反应后得到标准状况下2.24 L NO,剩余9.6 g金属;继续加入200 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下2.24 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法中正确的是( )
A.原混合物中铜和铁各0.15 mol
B.稀硝酸的物质的量浓度为1 mol·L-1
C.第一次剩余9.6 g金属为铜和铁
D.再加入上述200 mL稀硝酸,还会得到标准状况下2.24 L NO
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮专题复习 化学常用计量练习卷(解析版) 题型:实验题
某一种胃药中的抑酸剂为碳酸钙,其中所含的抑酸剂质量的测定如下:
①需配制0.1 mol·L-1的HCl溶液和0.1 mol·L-1的NaOH溶液
②取一粒(药片质量相同)0.2 g的此胃药片,磨碎后加入20.0 mL蒸馏水
③以酚酞为指示剂,用0.1 mol·L-1的NaOH溶液滴定,用去V mL达滴定终点
④加入25 mL 0.1 mol·L-1的HCl溶液
(1)写出实验过程的步骤(写编号顺序) 。
(2)下图所示容器中配制0.1 mol·L-1的HCl溶液和0.1 mol·L-1的NaOH溶液肯定不需要的仪器是(填序号) ,配制上述溶液还需要的玻璃仪器是 (填仪器名称)。

(3)配制上述溶液应选用的容量瓶规格是(填字母) 。
A.50 mL 50 mL
B.100 mL 100 mL
C.100 mL 150 mL
D.250 mL 250 mL
(4)写出有关的化学反应方程式: 、 。
(5)每粒胃药中含碳酸钙的质量为 g。
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮专题复习 化学常用计量练习卷(解析版) 题型:计算题
下表是用沉淀法测定KHCO3和Na2CO3混合物的组成的相关数据。实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应。实验记录见下表:
实验次数 | 称取样品的 质量/g | 所加Ba(OH)2 溶液的体积/L | 测得生成沉淀 的质量/g |
1 | 0.518 | 0.5 | 0.985 |
2 | 1.036 | 0.5 |
|
3 | 1.554 | 0.5 | 2.955 |
4 | 2.072 | 0.5 | 3.940 |
5 | 2.590 | 0.5 | 3.940 |
6 | 3.108 | 0.5 | 3.940 |
分析上表数据回答下列问题:
(1)第2次实验中产生沉淀多少克?请将结果填在表格相应空格中。
(2)样品中KHCO3和Na2CO3的物质的量之比是 。
(3)室温下,取上述Ba(OH)2溶液50 mL,加入0.05 mol·L-1的盐酸,反应后所得溶液的pH=2,求所加盐酸的体积(混合时不考虑溶液体积变化,写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com