
科目: 来源: 题型:解答题
| 操 作 | 结 论 | |
| 甲 | 火柴梗 | 变黑者为浓硫酸 |
| 乙 | 加入金属铝片 | 产生刺激性气味者为浓硫酸 |
| 丙 | 分别加入到盛水的试管中 | 放大量热者为浓硫酸 |
| 丁 | 打开试剂瓶塞 | 冒白烟者为浓硫酸 |
| 戊 | 加到CuSO4?5H2O 晶体中 | 使晶体变白者为浓硫酸 |
| 操 作 | 结 论 | |
| ______ | ______ |
查看答案和解析>>
科目: 来源: 题型:单选题
下列实验操作、现象与实验结论一致的是
| 选项 | 实验操作、现象 | 实验结论 |
| A | 向某溶液中加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失 | 该溶液中有SO42- |
| B | 甲苯中滴入少量浓溴水,振荡,静置,溴水层褪色 | 甲苯与溴发生了取代反应 |
| C | 将FeCl3溶液分别滴入NaBr、NaI溶液中,再分别滴加CCl4,振荡,静置 | 氧化性:Fe3+>Br2>I2 |
| D | 除锈的铁钉在浓硝酸中浸泡后,用蒸馏水洗净,再放入CuSO4溶液中无现象 | 铁钉表面形成了一层致密稳定的氧化膜 |
查看答案和解析>>
科目: 来源: 题型:解答题
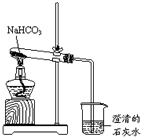 实验室利用如图所示装置进行NaHCO3的受热分解实验.请回答:
实验室利用如图所示装置进行NaHCO3的受热分解实验.请回答:查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
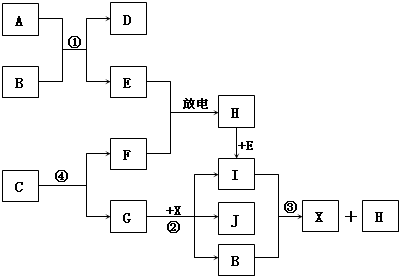
查看答案和解析>>
科目: 来源: 题型:解答题
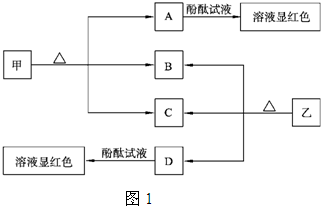
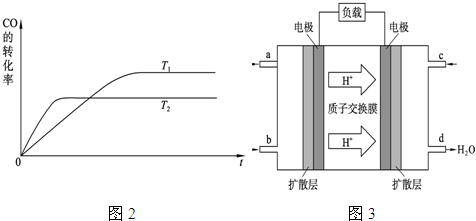
查看答案和解析>>
科目: 来源: 题型:解答题
 氯气是重要的化工原料.
氯气是重要的化工原料.查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com