
科目: 来源:2013-2014学年高考化学二轮专题冲刺第7讲 水溶液中的离子平衡练习卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中能大量共存的是(?? )
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.水电离出的c(H+)=10-12 mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
C.c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮专题冲刺第7讲 水溶液中的离子平衡练习卷(解析版) 题型:选择题
25℃时,在等体积的①pH=0的H2SO4溶液、②0.05 mol/L的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是(?? )
A.1∶10∶1010∶109???????? B.1∶5∶5×109∶5×108
C.1∶20∶1010∶109?????? ? D.1∶10∶104∶109
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮专题冲刺第7讲 水溶液中的离子平衡练习卷(解析版) 题型:选择题
在T℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T℃),测得混合溶液的部分pH如下表所示:
序号 | NaOH溶液体积 | 盐酸体积 | 溶液pH |
① | 20.00 | 0.00 | 8 |
② | 20.00 | 20.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c为(?? )
A.1? ??? B.4???????? C.5????? ? D.6
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮专题冲刺第7讲 水溶液中的离子平衡练习卷(解析版) 题型:选择题
下列关于常温下电解质溶液的叙述中,正确的是(?? )
A.碳酸氢铵溶液和足量氢氧化钠溶液混合的离子反应:HCO3-+OH-=CO32-+H2O
B.等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+c(NH4+)=c(Cl-)+c(OH-)
C.等物质的量浓度的NH4Cl溶液和NH3·H2O溶液,溶液中c(NH4+)前者小于后者
D.25℃时,pH=8的0.1 mol·L-1NaX溶液中由水电离出的c(OH-)=1×10-8 mol·L-1
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮专题冲刺第7讲 水溶液中的离子平衡练习卷(解析版) 题型:选择题
下列溶液中微粒浓度关系不正确的是(?? )
A.常温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)=c(NH4+)
B.pH=1的一元酸和pH=13的一元碱等体积混合:c(OH-)=c(H+)
C.0.1 mol·L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
D.0.1 mol·L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S)
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮专题冲刺第7讲 水溶液中的离子平衡练习卷(解析版) 题型:选择题
化工生产中含Cu2+的废水常用MnS(s)作沉淀剂,其反应原理为Cu2+(aq)+MnS(s)  CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是(?? )
CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是(?? )
A.该反应达到平衡时:c(Cu2+)=c(Mn2+)
B.CuS的溶解度比MnS的溶解度小
C.往平衡体系中加入少量Cu(NO3)2(s)后,c(Mn2+)变大
D.该反应平衡常数表达式:K=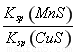
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮专题冲刺第7讲 水溶液中的离子平衡练习卷(解析版) 题型:选择题
人体血液里存在重要的酸碱平衡: ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
下列说法不正确的是(?? )
A.正常人体血液中,HCO3-的水解程度大于电离程度
B.人体血液酸中毒时,可注射NaHCO3溶液缓解
C.pH=7.00的血液中,c(H2CO3)<c(HCO3-)
D.pH=7.40的血液中,HCO3-的水解程度一定大于H2CO3的电离程度
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮专题冲刺第7讲 水溶液中的离子平衡练习卷(解析版) 题型:选择题
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是(?? )

A.在任何溶液中,c(Ca2+)、c(SO42-)均相等
B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L
C.a点对应的Ksp等于c点对应的Ksp
D.d点溶液通过蒸发可以变到c点
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮专题冲刺第7讲 水溶液中的离子平衡练习卷(解析版) 题型:填空题
为了证明一水合氨(NH3·H2O)是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验:0.010 mol·L-1氨水、0.1 mol·L-1NH4Cl溶液、NH4Cl晶体、酚酞试剂、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.010 mol·L-1氨水的pH为10,则认定一水合氨是弱电解质,你认为这一方法是否正确?________(填“是”或“否”)并说明理由______________
(2)乙取出10 mL 0.010 mol·L-1氨水,用pH试纸测出其pH=a,然后用蒸馏水稀释至1 000 mL,再用pH试纸测出其pH为b,若要确认NH3·H2O是弱电解质,则a、b值应满足什么关系?________(用“等式”或“不等式”表示)。
(3)丙取出10 mL 0.010 mol·L-1氨水,滴入2滴酚酞溶液,显粉红色,再加入NH4Cl晶体少量,颜色变浅。你认为这一方法能否证明NH3·H2O是弱电解质?并说明原因:______________________________________________________________________。
(4)请你根据所提供的试剂,再提出一个合理又简便的方案证明NH3·H2O是弱电解质:__________________________________________________________________。
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮专题冲刺第7讲 水溶液中的离子平衡练习卷(解析版) 题型:填空题
硫酸是强酸,中学阶段将硫酸在水溶液中看做完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为H2SO4=H++HSO4-,HSO4- H++SO42-。
H++SO42-。
请回答下列有关问题:
(1)Na2SO4溶液呈________(填“弱酸性”、“中性”或“弱碱性”),其理由是__________________________________________。(用离子方程式表示)。
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为_________________________。
(3)在0.10 mol·L-1的Na2SO4溶液中,下列离子浓度的关系正确的是________(填写编号)。
A.c(Na+)=c(SO42-)+c(HSO4-)+c(H2SO4)
B.c(OH-)=c(HSO4-)+c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-)
D.c(Na+)=2c(SO42-)+2c(HSO4-)
(4)若25℃时,0.10 mol·L-1的NaHSO4溶液中c(SO42-)=0.029 mol·L-1,则0.10 mol·L-1的H2SO4溶液中c(SO42-)________0.029 mol·L-1(填“<”、“>”或“=”),其理由是__________________________________________________________________。
(5)或25℃时,0.10 mol·L-1H2SO4溶液的pH=-lg 0.11,则0.10 mol·L-1H2SO4溶液中c(SO42-)=________ mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com