
科目: 来源:2013-2014学年陕西省等五校高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
某pH=1的X溶液中可能含有Fe2+、A13+、NH4+、CO32―、SO32―、SO42―、C1―中的若干种,现取X溶液进行连续实验,实验过程及产物如下:

下列说法正确的是
A.气体A是NO2???????????????????? ???? B.X中肯定存在Fe2+、A13+、NH4+、SO42―
C.溶液E和气体F不能发生化学反应?? ????? D.X中不能确定的离子是 A13+和C1―
查看答案和解析>>
科目: 来源:2013-2014学年陕西省等五校高三第一次模拟考试理综化学试卷(解析版) 题型:实验题
(14分)某兴趣小组同学在实验室用加热1-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,并检验反应的部分副产物,设计了如图所示装置,其中夹持仪器、加热仪器及冷却水管没有画出。
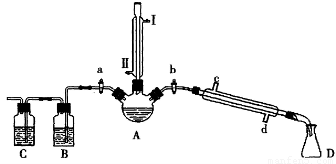
请根据实验步骤,回答下列问题:
(1)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。
竖直冷凝管接通冷凝水,进水口是_____(填“I”或“Ⅱ”);冷凝回流的主要目的是________。
(2)理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等。熄灭酒精灯,在竖直冷凝管上方塞上塞子并打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物。
B、C中应盛放的试剂分别是_________和????????? ,写出C装置中主要的化学方程式:___________。
(3)为了进一步分离提纯1-溴丁烷,该兴趣小组同学查得相关有机物的数据如表所示:
物质 | 熔点/℃ | 沸点/℃ |
1-丁醇 | -89.5 | 117.3 |
1-溴丁烷 | -112.4 | 101.6 |
丁醚 | -95.3 | 142.4 |
1-丁烯 | -185.3 | -6.5 |
请你补充下列实验步骤,直到分离出1-溴丁烷。
①待烧瓶冷却后,拔去竖直的冷凝管;
②____;③_____;④_______;⑤_______,收集所得馏分。
(4)若实验中所取1-丁醇、NaBr分别为7.4 g、13.0 g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6 g1-溴丁烷,则1-溴丁烷的产率是_____。(保留2位有效数字)
查看答案和解析>>
科目: 来源:2013-2014学年陕西省等五校高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:

请回答下列问题:
(1)步骤①所得废渣的成分是??????????? (写化学式),操作I的名称?????? 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是???????????????????????????? 。
③中X试剂为??????????????????? 。
(3)⑤的离子方程式为???????????????????????? 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为?????????? ;
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<????????????? 。
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有?????????????? 和??????? 。
查看答案和解析>>
科目: 来源:2013-2014学年陕西省等五校高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如右图所示,根据下图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如右图所示,根据下图回答下列问题:
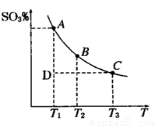
①2SO2(g)+O2(g) 2SO3(g)的△H__________0(填“>”或“<”),
2SO3(g)的△H__________0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是???????? 。
A.体系的密度不发生变化???? ????????????? ? B.SO2与SO3的体积比保持不变
C.体系中硫元素的质量百分含量不再变化??? ?? D.单位时间内转移4 mol 电子,同时消耗2 mol SO3
E.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g)  2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。

图1 ????? ? ? 图2?? ???? ? 图3
①该反应的平衡常数表达式为?????????? ,升高温度,平衡常数????????? (填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)=??????? ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为??????? (填“a”或“b”或“c”或“d”)
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 ????? 点,温度T1 ?? T2(填“>”或“=”或“<”)
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈???? 性,所得溶液中c(H+)- c(OH-)=??????????? (填写表达式)(已知:H2SO3:Ka1=1.7×10-2,Ka2=6.0×10-8,NH3·H2O:Kb=1.8×10-5)
查看答案和解析>>
科目: 来源:2013-2014学年陕西省等五校高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为?????????? 和???????????????
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示:
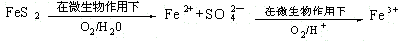
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为??????????????????????? ;第二步反应的离子方程式为????????????????? 。
(3)工业煤干馏得到的产品有焦炭、????????????? 、?????????????? 等。
(4)湿式石灰石—石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏,经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
①写出湿法石灰石—石膏法脱硫所涉及的化学反应方程式:______________________。
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是:_________________________
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则石膏产品性能变坏。工业上消除可溶性氯化物的方法是____________________________________?? 。
(5)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4·xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示。数据表明当固体的质量为2.72g后不再改变。①石膏的化学式为_______________。②图像中AB段对应化合物的化学式为_________________。
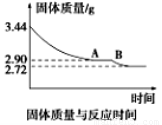
查看答案和解析>>
科目: 来源:2013-2014学年陕西省等五校高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素。已知:
①Q为元素周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的能级,且每种能级中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,Q、R两种元素组成的原子个数比为1:1的化合物N的质荷比最大值为78;
⑤Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同。
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示)
(1)化合物M的空间构型为???????? ,其中心原子采取??? 杂化;化合物N在固态时的晶体类型为??????????? 。
(2)R、X、Y三种元素的第一电离能由小到大的顺序为???????????????? 。
(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为????????? (写分子式)。
(4)Z原子基态时的外围电子排布式为????? ;Z的一种含氧酸钡盐的晶胞 结构如图所示,晶体内与每个Z原子等距离且最近的氧原子数为??? 。

(5)由R、X、Y三种元素组成的RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物质。该反应的离子方程式为???? 。
查看答案和解析>>
科目: 来源:2013-2014学年陕西省等五校高三第一次模拟考试理综化学试卷(解析版) 题型:推断题
有机物丙(C13H18O2)是一种香料,其合成路线如图所示。其中A的相对分子质量通过质谱法测得为56,它的核磁共振氢谱显示只有三组峰;D可以发生银镜反应,在催化剂存在条件下1 mol D与2 mol H2反应可以生成乙;丙中含有两个-CH3

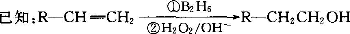
(1)A的结构简式为??????????? ;乙的分子式为???????????? 。
(2)C与新制Cu(OH)2悬浊液反应的化学方程式_________________。
(3)D所含官能团的名称是???????????????????? ;D有多种同分异构体,其中与其所含官能团相同的同分异构体有????????? 种(不考虑立体异构)。
(4)甲与乙反应的化学方程式为????????????????????????????????????? 。
(5)写出满足下列条件的有机物的结构简式????????????????????????? ⅰ与乙互为同分异构体;ⅱ遇FeCl3溶液显紫色;ⅲ其苯环上的一溴代物只有两种。
查看答案和解析>>
科目: 来源:2013-2014学年陕西省等五校高三第二次联考理综化学试卷(解析版) 题型:选择题
下列说法正确的是 (????? )?
A.天然气和液化石油气的主要成分都是甲烷
B.甘氨酸和丙氨酸脱水,最多可生成3种二肽
C.古代的陶瓷、砖瓦,现代的有机玻璃、水泥都是硅酸盐产品
D.K2FeO4能与水作用生成Fe(OH)3胶体和O2,可用于自来水的净化和杀菌消毒
查看答案和解析>>
科目: 来源:2013-2014学年陕西省等五校高三第二次联考理综化学试卷(解析版) 题型:选择题
化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语正确的是(??? )
A.0.5mol/L氢氧化钙溶液和0.5mol/L碳酸氢镁溶液等体积混合反应:Ca2++ OH-+ HCO3=CaCO3↓+H2O
B.少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++2ClO- = CaSO3↓+2HClO
C.将11.2L标准状况下的氯气通入200mL2mol/L的FeBr2溶液中,离子反应方程式为:2Fe2++8Br-+5Cl2=2Fe3++4Br2+10Cl-
D.某锂电池电极总反应为:4Li+2SOCl2 = 4LiCl+S+SO2↑,则正极反应为:2SOCl2 + 4e-= 4Cl-+S +SO2↑
查看答案和解析>>
科目: 来源:2013-2014学年陕西省等五校高三第二次联考理综化学试卷(解析版) 题型:选择题
分子式为C5H12O的醇与和它相对分子质量相同的一元羧酸进行酯化反应,生成的酯共有(不考虑立体异构)(??? )种
A.15????????????? B.16????????????? C.17???????????? D.18
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com