
科目: 来源:2013-2014学年河北省邯郸市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
常温下,pH=11的氨水和pH=1的盐酸等体积混合(混合溶液体积为两溶液体积之和),恰好完全中和,则下列说法错误的是
A.氨水的浓度等于盐酸的浓度
B.原氨水中有1%的含氮微粒为NH4+
C.氨水中水电离出的c(H+)是盐酸中水电离出的c(H+)的100倍
D.混合溶液中c(NH4+)+c(NH3·H2O)+c(NH3)=5×10-4mol·L-1
查看答案和解析>>
科目: 来源:2013-2014学年河北省邯郸市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是
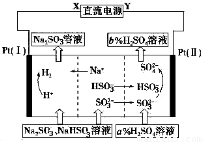
A.X为直流电源的负极,Y为直流电源的正极
B.阳极区pH增大
C.图中的b>a
D.该过程中的产品主要为H2SO4和H2
查看答案和解析>>
科目: 来源:2013-2014学年河北省邯郸市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
随着大气污染的日趋严重,国家拟于“十二”五期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) =4NO(g) + CO2(g) +2H2O(g)??? ⊿H= -574 kJ·mol-1
②CH4(g) +4NO(g) =2N2(g) + CO2(g) + 2H2O(g)??? ⊿H= -1160 kJ·mol-1
③H2O(g) = H2O(l)???? △H= -44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式?????????? 。
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为????????????????????????????????? 。
??? 浓度/mol·L-1
| NO | N2 | CO2 |
0 | 1.00 | 0 | 0 |
10 | 0.58 | 0.21 | 0.21 |
20 | 0.40 | 0.30 | 0.30 |
30 | 0.40 | 0.30 | 0.30 |
40 | 0.32 | 0.34 | 0.17 |
50 | 0.32 | 0.34 | 0.17 |
(3)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)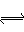 N2 (g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①10min~20min以v(CO2) 表示的平均反应速率为 ?????????????????????? 。
②根据表中数据,计算T1℃时该反应的平衡常数为??? ??? (保留两位小数)。
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率?????? (填“增大”、“不变”或“减小”) 。
④下列各项能作为判断该反应达到平衡的是 (填序号字母)。
A.容器内压强保持不变
B.2v正(NO) = v逆(N2)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
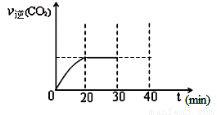
⑤30min末改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是?????????? 。请在图中画出30min至40min 的变化曲线。
查看答案和解析>>
科目: 来源:2013-2014学年河北省邯郸市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
为了降低电子垃圾对环境构成的影响,将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
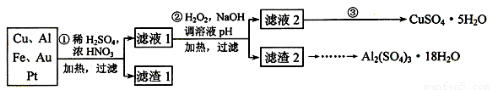
(1)第①步Cu与混酸反应的离子方程式为______________________________。得到滤渣1的主要成分为_________________。
(2)第②步中加入H2O2的作用是__________________,使用H2O2的优点是_________;调溶液pH的目的是____________________________________。
(3)简述第③步由滤液2得到CuSO4·5H2O的方法是_________________________
____________________________________________________________ 。
(4)由滤渣2制取Al2(SO4)3·18H2O ,设计了以下三种方案:

上述三种方案中,_______方案不可行,原因是_______________________________;
从原子利用率角度考虑,_______方案更合理。
(5)用滴定法测定CuSO4·5H2O含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2+ + H2Y2-→ CuY2- + 2H+。写出计算CuSO4·5H2O质量分数的表达式ω= __________________ 。
查看答案和解析>>
科目: 来源:2013-2014学年河北省邯郸市高三第一次模拟考试理综化学试卷(解析版) 题型:实验题
如图1所示是实验室中制取气体的一种简易装置。
(1)请简述检验它的气密性的方法??????????????????????????????????????? 。
(2)利用如图1所示装置制取气体时,可适用的反应条件和反应物状态为________________________。
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态。请回答有关问题。
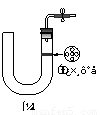

(3)已知16.9%稀硝酸的密度为1.10g·cm-3,则其物质的量浓度为____________(计算结果保留两位小数)。若用63%的硝酸配制16.9%稀硝酸500mL,所需的玻璃仪器有量筒、玻璃棒、烧杯、???????????? 。
(4)实验开始时,先打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是???????????????? 。B装置烧杯中液体的作用是_________________________。当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体。
(5)现有仪器和药品:试管和胶头滴管,0.1mol·L-1KSCN溶液、0.2mol·L-1酸性KMnO4溶液、0.1mol·L-1KI溶液、氯水等。请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告:
实验步骤 | 操作 | 现象与结论 |
第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液。 |
|
第二步 |
| 若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+。 |
查看答案和解析>>
科目: 来源:2013-2014学年河北省邯郸市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
硅在地壳中的含量较高,硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)陶瓷、水泥和玻璃是常用的传统的无机非金属材料,其中生产普通玻璃的主要原料有????????????????????? 。
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
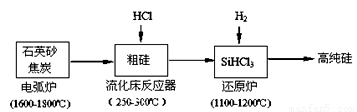
①工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃除生成粗硅外,也可以生产碳化硅,则在电弧炉内可能发生的反应的化学方程式为??????????????????????? 。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,粗硅生成SiHCl3的化学反应方程式?????????????????????????????? 。
(3)有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和??????? ;SiHCl3极易水解,其完全水解的产物为??????? 。
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
(4)还原炉中发生的化学反应为:???????????????????????????????? 。
(5)氯碱工业可为上述工艺生产提供部分原料,这些原料是??????? 。
查看答案和解析>>
科目: 来源:2013-2014学年河北省邯郸市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于周期表的_______区;溴的价电子排布式为____________________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________________。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_________。
| 氟 | 氯 | 溴 | 碘 | 铍 |
第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
(4)已知高碘酸有两种形式,化学式分别为H5IO6( )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)
(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-。与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____式发生。
A.CsICl2=CsCl+ICl??????? B.CsICl2=CsI+Cl2
(6)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(7)已知CaF2晶体(见图)的密度为ρ g·cm-3,NA为阿伏加德罗常数,最近相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
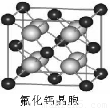
查看答案和解析>>
科目: 来源:2013-2014学年河北省邯郸市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
PTT是近几年来迅速发展起来的新型热塑性聚酯材料,具有优异性能,能作为工程塑料、纺织纤维和地毯等材料而得到广泛应用。其合成路线可设计为:

其中A、B、C均为链状化合物,A能发生银镜反应,C中不含甲基,1mol C可与足量钠反应生成22.4 L H2(标准状况)。请回答下列问题:
(1)A中所含官能团的名称为 ???? ,B的结构简式为 ????????????????? 。
(2)由物质C与D反应生成PTT的化学方程式为 ????????????????????????? ,
反应类型为 ?????????? 。
(3)分子式为C4H6O与A互为同系物的同分异构体有 ??? 种。
(4)请写出以CH2=CHCH3为主要原料(无机试剂任用)制备CH3CH(OH)COOH的合成路线流程图(须注明反应条件)。
已知: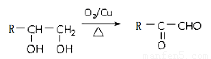
(合成路线常用的表示方式为:A B……
B…… 目标产物)
目标产物)
查看答案和解析>>
科目: 来源:2013-2014学年河南省开封市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列有关说法中,不正确的是
A.焰火的五彩缤纷是某些金属元素的性质的展现
B.SiO2可用于制造光导纤维,其性质稳定,不溶于强酸、强碱
C.“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关
D.根据分散质微粒直径大小可以将分散系分为溶液、胶体和浊液
查看答案和解析>>
科目: 来源:2013-2014学年河南省开封市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列与有机结构、性质相关的叙述中,正确的是
A.乙醇与金属钠反应比水与金属钠反应更剧烈
B.乙烯和聚乙烯均能和溴水发生加成反应而使溴水褪色
C.蛋白质、淀粉、纤维素、蔗糖都属于有机高分子化合物
D.乙酸、甲酸甲酯和羟基乙醛( )互为同分异构体
)互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com