
科目: 来源:2013-2014学年河北省石家庄市毕业班教学质量检测(二)理综化学试卷(解析版) 题型:选择题
关于下列图像的叙述正确的是
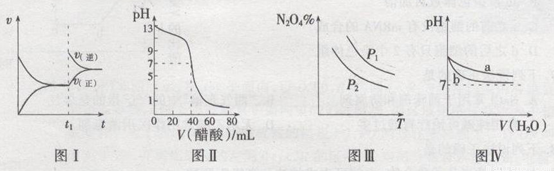
A.图I表示:反应I2(g)+H2(g)  2HI(g) ΔH<0发热v-t关系,其中t1时刻改变的条件为升高温度
2HI(g) ΔH<0发热v-t关系,其中t1时刻改变的条件为升高温度
B.图Ⅱ表示:25℃时,用醋酸溶液滴定40.00 mL 0.1000 mol·L-1NaOH溶液的滴定曲线,其中c(CH3COOH)=0.1000mol/L
C.图Ⅲ表示:反应2NO2(g)  N2O4(g)的平衡体系中,N2O4的百分含量与温度(T)、压强(P)的变化关系,其中△H<0、P1<P2
N2O4(g)的平衡体系中,N2O4的百分含量与温度(T)、压强(P)的变化关系,其中△H<0、P1<P2
D.图Ⅳ表示:25℃时,分别稀释等体积,等pH的NaOH溶液与氨水时的pH变化,其中曲线a对应氨水
查看答案和解析>>
科目: 来源:2013-2014学年河北省石家庄市毕业班教学质量检测(二)理综化学试卷(解析版) 题型:填空题
合成氯是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g)  2NH3(g) ΔH=-93.0kJ/mol
2NH3(g) ΔH=-93.0kJ/mol
(1)某温度下,在2 L密闭容器中发生上述反应,测得数据如下
??????????? 时间/h 物质的量/mol | 0 | 1 | 2 | 3 | 4 |
N2 | 2.0 | 1.83 | 1.7 | 1.6 | 1.6 |
H2 | 6.0 | 5.49 | 5.1 | 4.8 | 4.8 |
NH3 | 0 | 0.34 | 0.6 | 0.8 | 0.8 |
①0~2 h内,v(N2)=??????????? 。
②平衡时,H2的转化率为____;该温度下,反应2NH3(g)  N2(g)+3H2(g)的平衡常数K=?? 。
N2(g)+3H2(g)的平衡常数K=?? 。
③若保持温度和体积不变,起始投入的N2、H2、NH3的物质的量分别为a mol、b mol、c mol,达到平衡后,NH3比的浓度与上表中相同的为?????? (填选项字母)。
A.a=l、b=3.c=0? ?????? B.a=4、b=12、c=0
C.a=0、b=0.c=4? ???? D.a=l、b=3、c=2
(2)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热ΔH=-286kJ/mol,则陪制NH3反应的热化学方程式为 ??????? 。
(3)采用高质子导电性的SCY陶瓷(能传递H'),通过电解法也可合成氨,原理为:
N2(g)+3H2(g)  2NH3(g)。在电解法合成氨的过程申,应将N2不断地通入?? ___极,该电极反应式为?????????????????????? 。
2NH3(g)。在电解法合成氨的过程申,应将N2不断地通入?? ___极,该电极反应式为?????????????????????? 。
查看答案和解析>>
科目: 来源:2013-2014学年河北省石家庄市毕业班教学质量检测(二)理综化学试卷(解析版) 题型:填空题
工业上可以从电解铜的阳极泥中提取很多重要物质,其工艺流程如下:
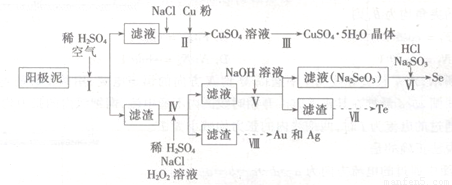
已知:①阳极泥的主要化学成分,如表1所示
表一
主要成份 | Cu??? Ag???? Au????? Se???? Te |
百分含量/% | 23.4??? 12.1???? 0.9???? 6.7???? 3.1 |
②温度和硫酸浓度对阳极泥中各组分浸出率的影响,如表2所示
表二
| 固定浸出温度 |
|
| 固定H2SO4浓度
|
H2SO4浓度 mol/L | 浸出率/% |
| 浸出温度/℃ | 浸出率/% |
Cu? Ag? Au? Se? Te |
| Cu? Ag? Au? Se? Te | ||
4 | 95.1 4.67? <0.2? 0.83 8.93 |
| 30 | 87.1 4.58? <0.2 0.08 6.83 |
3 | 94.5 4.65? <0.2? 0.28 6.90 |
| 40 | 94.5 4.65? <0.2? 0.28 6.90 |
2 | 78.1 2.65? <0.2? 0.05 2.85 |
| 50 | 96.1 5.90? <0.2? 0.64 8.73 |
(1)步骤I的主要目的为浸出铜,此过程中发生的主要反应的化学方程式为____________分析表2数据,可知步骤I最适合的条件为??????????????????? 。
(2)步骤Ⅱ中,加入Cu粉的目的是除去滤液中含碲的离子,加入NaCl的目的为____。
(3)步骤Ⅲ的操作方法为????????????????????? 。
(4)步骤Ⅳ中,反应温度为75℃。加入H2O2溶液的作用为?????????????????? ;此过程中H2O2溶液的添加量要远远高于理论值,原因为?????????????????? 。
(5)步骤Ⅵ中所发生反应的化学方程式为?????? ???????????????? 。
(6)步骤Ⅶ中,Te的获得可以通过碱性环境下电解Na2TeO3溶液实现,其阴极的电极反应式为 ???? 。
(7)步骤Ⅷ中得到的Au和Ag混合物可以用____进行分离(填选项字母)。
A.稀硝酸 ?? B.浓盐酸? ?? C.浓氢氡化钠溶液? ?? D.王水
查看答案和解析>>
科目: 来源:2013-2014学年河北省石家庄市毕业班教学质量检测(二)理综化学试卷(解析版) 题型:实验题
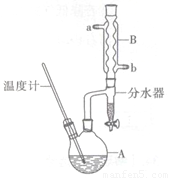
正丁醚常用作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下:
2CH3CH2CH2CH2OH (CH3CH2CH2CH2)2O+H2O
(CH3CH2CH2CH2)2O+H2O
反应物和产物的相关数据如下
| 相对分子质量 | 沸点/℃ | 密度/(g/cm3) | 水中溶解性 |
正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
合成反应:
①将6 mL浓硫酸和37 g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。分离提纯:
③待A中液体冷却后将其缓慢倒人盛有70 mL水的分液谝斗中,振摇后静置,分液得粗产物。
④粗产物依次用40 mL水、20 mL NaOH溶液和40 mL水洗涤,分液后加入约3 g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11 g。
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为??????????????????????? 。
(2)加热A前,需先从____(填“a”或“b”)口向B中通入水。
(3)步骤③的目的是初步洗去??????????? ,振摇后静置,粗产物应从分液漏斗的??????? (填“上”或“下”)口分离出。
(4)步骤③中最后一次水洗的目的为???????????????????? 。
(5)步骤⑤中,加热蒸馏时应收集??????? (填选项字母)左右的馏分。
A.100℃???? B.117℃?? ? C.135℃?????? D.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分为____,下层液体的主要成分为???????????? 。
(7)本实验中,正丁醚的产率为??????????? 。
查看答案和解析>>
科目: 来源:2013-2014学年河北省石家庄市毕业班教学质量检测(二)理综化学试卷(解析版) 题型:填空题
硫酸的工业制备是一个重要的化工生产过程,但在生产过程中会产生大量污染,需要在生产工艺中考虑到绿色工艺。
I尾气的吸收和综合利用。
以工业制硫酸的尾气、氨水、石灰石、焦炭、碳酸氯铵和KCI为原料可以合成硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
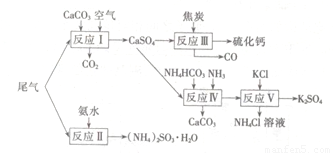
(1)反应III中氧化剂与还原剂的物质的量之比为???????????? 。
(2)反应Ⅳ的化学方程式为?????????????????????? 。
(3)反应V在25℃、40%的乙二醇溶液中进行,该反应能顺利进行的原因为??????????? 。
Ⅱ催化剂的回收利用。
SO2的催化氧化所使用的催化剂为V2O5,实际生产中,催化剂在使用一段时间后,会含有V2O5、VOSO4和SiO2等,其中VOSO4。能溶于水。回收V2O5,的主要流程如下:
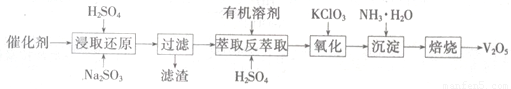
(4)若反萃取使用的硫酸用量过大,进一步处理时会增加____??????? 的用量。
(5)浸取还原过程的产物之一是VOSO4,反应的化学方程式为?????????????????? 。
氧化过程的化学方程式为KClO3+6VOSO4+3H2SO4= 2(VO)2(SO4)3+KCl+3H2O;若两步所用试剂Na2SO3与KC1O3的物质的量之比为12:7,则该催化剂中V2O5、VOSO4的物质的量之比为??????????????? 。
查看答案和解析>>
科目: 来源:2013-2014学年河北省石家庄市毕业班教学质量检测(二)理综化学试卷(解析版) 题型:填空题
铜、铁、钒都是日常生活中常见的金属,具有广泛用途。请回答:
(1)在元素周期表中,铜元素位于____区,其基态原子的电子排布式为???????? 。
(2)Cu2O的熔点比Cu2S高,原因为??????????????????????? 。
(3)Fe(CO)5是一种常见的配合物,可代替四乙基铅作为汽油的抗爆震剂。
①写出CO的一种常见等电子体分子的结构式____;两者相比较沸点高的为?????? (填分子式)。
②Fe(CO)5在一定条件下发生反应:Fe(CO)5(s)=Fe(s)+5CO(g),已知:反应过程中,断裂的化学键只有配位键,由此判断该反应所形成的化学键类型为???????? 。
(4)已知AlCl3·NH3和AlCl4—中均有配位键。AlCl3·NH3中,提供空轨道的原于是____;在AlCl4中Al原子的杂化轨道类型为??????????? 。
(5)金属铝的晶胞结构如图甲所示,原子之间相对位置关系的平面图如图乙所示。则晶体铝中原子的堆积方式为____。已知:铝原子半径为d cm,摩尔质量为M g·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=??????????? 。

查看答案和解析>>
科目: 来源:2013-2014学年河北省石家庄市毕业班教学质量检测(二)理综化学试卷(解析版) 题型:填空题
芳香族化合物A是医药工业中的重要合成原料,分子中只含C、H、O三种元素,H、O两种元素的质量比为1:8,且其相对分子质量小于150。取等质量的A分别与足量NaHCO3和Na反应,生成的气体在同温同压下的体积比为1:l。
(1)A的分子式为____;A中含有的官能团的名称为???????????? 。
(2)由A合成治疗溃疡药物奥沙拉秦钠(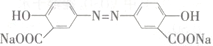 )的路线如图所示:
)的路线如图所示:
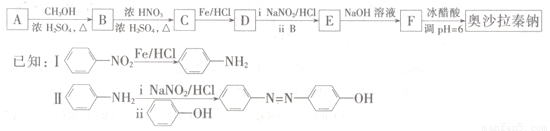
①奥沙托秦钠的核磁共振氢谱有____个吸收峰。
②D不可能发生的反应类型有????????????? (填选项字母)。
A.取代反应? ?? ? B.加成反应? ? ? C.消去反应? ?? D.氧化反应
③由E→F的化学反应方程式为__________________________。
④符合下列条件的B的同分异构体有____种;写出其中任意一种的结构简式____。
i苯环上有2个取代基,且能发生水解反应和镊镜反应;
ii mol该物质与足量的Na反应生成0.5 mol H2。
查看答案和解析>>
科目: 来源:2013-2014学年江苏省南通市高三第一次调研测试化学试卷(解析版) 题型:选择题
2013年11月江苏在大部分地市推广使用含硫量大幅减少的苏V汽油。下列有关汽油的说法正确的是
A.汽油属于可再生能源?????????????????? B.将原油通过萃取、分液可获得汽油
C.使用苏V汽油可降低酸雨发生率??????? D.苏V汽油只含C、H、O三种元素
查看答案和解析>>
科目: 来源:2013-2014学年江苏省南通市高三第一次调研测试化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.水的电子式: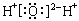
B.中子数为20的氯原子:
C.聚丙烯的结构简式:
D.钠原子的结构示意图:
查看答案和解析>>
科目: 来源:2013-2014学年江苏省南通市高三第一次调研测试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1盐酸的澄清透明溶液:Fe3+、K+、SO42- 、Br-
B.含有NaNO3的溶液:H+、Fe2+、SO42- 、Cl-
C.能使石蕊变红的溶液:Cu2+、Na+、AlO2-、Cl-
D.由水电离出的c(H+)·c(OH-)=10-22的溶液:Na+、Ca2+、HCO3- 、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com