
科目: 来源:2013-2014学年江西省八校高三下学期联考理综化学试卷(解析版) 题型:选择题
BHT(Butylated Hydroxy Toluene)是一种常用的食品抗氧化剂,合成方法有如下两种:

下列说法正确的是( )
A.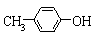 与BHT互为同系物
与BHT互为同系物
B. 属于芳香烃
属于芳香烃
C.BHT能与NaHCO3溶液反应生成CO2
D.两种方法的反应类型都是加成反应
查看答案和解析>>
科目: 来源:2013-2014学年江西省八校高三下学期联考理综化学试卷(解析版) 题型:选择题
甲、乙、丙、丁是原子序数依次增大的四种短周期元素,A、B、C、D、E是由其中的两种或三种元素组成的化合物,F是由丙元素形成的单质。已知:A + B = D + F,A + C = E + F; 0.1 mol·L-1D溶液的pH为13(25℃)。下列说法正确的是(??? )
A.原子半径:丁>丙>乙>甲
B.1 molA与足量B完全反应共转移了2 mol电子
C.丙元素在周期表中的位置为第二周期第ⅣA族
D.A中既有离子键又有共价键
查看答案和解析>>
科目: 来源:2013-2014学年江西省八校高三下学期联考理综化学试卷(解析版) 题型:选择题
下列叙述或表示正确的是
A.0.1 mol·L-1的醋酸的pH=a,0.01 mol·L-1的醋酸的pH=b,则a+1=b
B.常温下0.1 mol·L-1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COOˉ)=0.1 mol·L-1
C.难溶电解质AB2的饱和溶液中,c(A2+)=xmol·L-1,? c(B-)=y mol·L-1,则Ksp值为4xy2
D.用200mL4 mol·L-1的NaOH溶液将0.6mol CO2完全吸收,反应的离子方程式为:3CO2+4OHˉ=CO32ˉ+2HCO3ˉ+H2O
查看答案和解析>>
科目: 来源:2013-2014学年江西省八校高三下学期联考理综化学试卷(解析版) 题型:选择题
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是
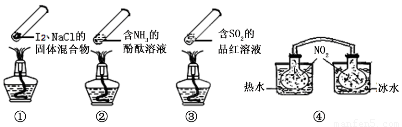
A.加热时,①上部汇聚了固体碘,说明碘的热稳定性较差
B.加热时,②、③中的溶液均变红,冷却后又都变为无色
C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅(已知:2NO2 (g) N2O4(g)△H<0)
N2O4(g)△H<0)
D.四个“封管实验”中都有可逆反应发生
查看答案和解析>>
科目: 来源:2013-2014学年江西省八校高三下学期联考理综化学试卷(解析版) 题型:选择题
组成和结构可用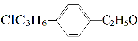 表示的有机物中,能发生消去反应的共有
表示的有机物中,能发生消去反应的共有
A.10种???????? B.16种?????????? C.20种????????? D.25种
查看答案和解析>>
科目: 来源:2013-2014学年江西省八校高三下学期联考理综化学试卷(解析版) 题型:选择题
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)的传感器煤矿巷道中的甲烷达到一定浓度时可以显示。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述不正确的是

A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B.电极b是正极,O2-由电极b流向电极a
C.电极a的反应式为:CH4 + 4O2- - 8e- = CO2 + 2H2O
D.当固体电解质中有1 molO2- 通过时,电子转移2 mol
查看答案和解析>>
科目: 来源:2013-2014学年江西省八校高三下学期联考理综化学试卷(解析版) 题型:实验题
绿矾(FeSO4?7H2O)是治疗缺铁性贫血的特效药。某学校的化学兴趣小组的同学对绿矾进行了如下的探究:
FeSO4?7H2O的制备
该化学兴趣小组的同学在实验室通过如下实验由废铁屑(含少量氧化铜、氧化铁等杂质)制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去
Na2CO3溶液,然后将废铁屑用水洗涤2~3遍。
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是 。
(2)实验步骤②明显不合理,理由是 。
(3)为了洗涤除去晶体表面附着的硫酸等杂质,实验步骤④中用少量冰水洗涤晶体,原因是 。
(二)探究绿矾(FeSO4·7H2O)热分解的产物
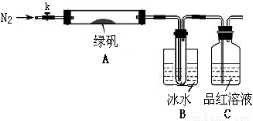 已知SO3的熔点是16.8°C,沸点是44.8°C,该小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
已知SO3的熔点是16.8°C,沸点是44.8°C,该小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
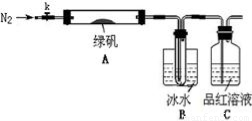
【实验过程】
①仪器连接后,检查装置A与B气密性;
②取一定量绿矾固体置于A中,通入N2以驱尽装置内的空气,关闭k,用酒精灯加热硬质玻璃管;
③观察到A 中固体逐渐变红棕色,B中试管收集到无色液体,C中溶液褪色;
④待A中反应完全并冷却至室温后,取少量反应后固体于试管中,加入硫酸溶解,取少量滴入几滴KSCN溶液,溶液变红色;
⑤往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊。
(4)实验结果分析
结论1:B中收集到的液体是?????????????????? ;
结论2:C中溶液褪色,可推知产物中有???? ?????????????? ;
结论3:综合分析上述实验③和④可推知固体产物一定有Fe2O3。
【实验反思】
(5)请指出该小组设计的实验装置的明显不足:??????????????????????????? 。
(6)分解后的固体中可能含有少量FeO,取上述实验④中盐酸溶解后的溶液少许于试管中,选用一种试剂鉴别,该试剂最合适的是?????????? 。
a.氯水和KSCN溶液???? b.酸性KMnO4溶液????? c.H2O2???? d.NaOH溶液
查看答案和解析>>
科目: 来源:2013-2014学年江西省八校高三下学期联考理综化学试卷(解析版) 题型:填空题
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品,工业上常用铝土矿(主要成分为Al2O3)来生产铵明矾NH4Al(SO4)2?12H2O,其工艺流程图如下
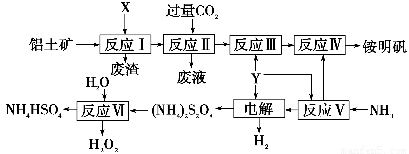
(1)流程图中X的电子式?????????????? , Y为?????? ????? (填化学式)溶液
(2)反应Ⅱ的离子方程式为???????????????????????????????????
(3)流程中可以循环使用的物质的名称是?????????????????????????
(4)反应Ⅵ的化学方程式为??????????????????????????????????????????
(5)对铵明矾NH4Al(SO4)2·12H2O高温分解的气体产物的预测不合理的是???????? 。
A.NH3、N2、SO2、H2O????? B.NH3、SO3、H2O
C.NH3、SO2、H2O????????? D.NH3、N2、SO3、SO2、H2O
(6)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中Al2O3和H2SO4的物质的量之比为____。
(7)向硫酸铝铵溶液中逐滴加入氢氧化钡溶液,不可能发生的反应是
A.4NH4Al(SO4)2+3Ba(OH)2=2(NH4)2SO4+3BaSO4↓+ Al2 (SO4)3+2Al(OH)3↓
B.2NH4Al(SO4)2+4Ba(OH)2=(NH4)2SO4+3BaSO4↓+Ba(AlO2)2
C.2NH4Al(SO4)2+3Ba(OH)2=(NH4)2SO4+3BaSO4↓+2Al(OH)3↓
D.NH4Al(SO4)2+2Ba(OH)2=NH3·H2O+2BaSO4↓+ Al(OH)3↓
查看答案和解析>>
科目: 来源:2013-2014学年江西省八校高三下学期联考理综化学试卷(解析版) 题型:填空题
目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: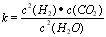 它所对应的化学反应为:__? ___
它所对应的化学反应为:__? ___
(2)—定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如下表所示:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol[ | 达到平衡所需时间/min | |
C(s) | H2O(g) | H2(g) | ||||
甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
乙 | 1 | T2 | 1 | 2 | 1,2 | 3 |
①T10C时,该反应的平衡常数K=_______
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度_______ (填选项字母)。
A.=0.8 mol·L-1??? B.=1.4 mol·L-1??? C.<1.4 mol·L-1??? D.>1.4 mol·L-1
③丙容器的容积为1L,T1℃时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g), 达到平?? 衡时各气体的体积分数与甲容器完全相同的是_______(填选项字母)。
A.0.6 mol、1.0 mol、0.5 mol、1.0 mol??
B. 0.6 mol、2.0 mol、0 mol、0 mol
C.1.0 mol、2.0 mol、1.0 mol、2.0 mol??????
D. 0.25 mol、0.5 mol、0.75 mol、1.5 mol
(3)在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,已知CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式:?????????????????????????????? 。
(4)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g)+ 6H2(g) CH3OCH3(g)+ 3H2O(g)
CH3OCH3(g)+ 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
投料比[n(H2)/ n(CO2)] | 500 K | 600 K | 700 K | 800 K |
1.5 | 45% | 33% | 20% | 12% |
2.0 | 60% | 43% | 28% | 15% |
3.0 | 83% | 62% | 37% | 22% |
①该反应的焓变△H?? 0,熵变△S___0(填>、<或=)。
②用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式?????????????? 。若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜???????? g。
查看答案和解析>>
科目: 来源:2013-2014学年江西省八校高三下学期联考理综化学试卷(解析版) 题型:填空题
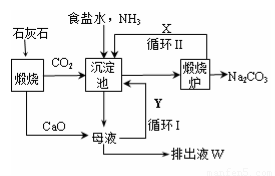
1862年,比利时化学家索尔维发明了氨碱法制碱,1926年,我国化学家侯德榜创立了
更为进侯德榜制碱法,也叫联合制碱法,两种制碱的生产流程可简要表示如下图:
 ??
?? 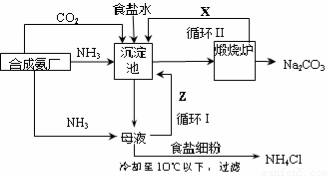
??????? 氨碱法生产流程??????????????????????? 联合制碱法生产流程
(1)向沉淀池中通入CO2和氨气时,应先通入氨气的原因是????????????????????????????? 。
(2)沉淀池中发生反应的化学反应方程式是 ???????????????????????????? ? 从沉淀池中分离沉淀的操作是???????? 。
(3)氨碱法生产流程示意图中的Y是????????????????? ,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为 ?????????????????????????????? 。
(4)联合制碱法中从滤液中提取氯化铵晶体的过程推测,所得结论正确是??? (选填编号)。
a.常温时氯化铵的溶解度比氯化钠小?
b.通入氨气能增大NH4+的浓度,使氯化铵更多析出
c.加入食盐细粉能提高Na+的浓度, 使NaHCO3结晶析出
d.通入氨气能使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(5)联合制碱法相比于氨碱法,氯化钠利用率从70%提高到90%以上,主要是设计了循环Ⅰ,联合制碱法的另一项优点是?????????????????????????????????????????????????????????? 。
(6)产品纯碱中含有碳酸氢钠,可以用加热分解的方法测定产品中纯碱的质量分数,已知样品质量为ag,加热至质量不再改变时称重为bg,则纯碱的质量分数为??????????????? 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com