
科目: 来源:2013-2014学年上海市八校高三年级联合调研考试化学试卷(解析版) 题型:选择题
在抽滤瓶内放一小块金属钠,同时收集满CO2气体并塞紧瓶塞。从分液漏斗中放入一定量的水,待钠完全反应并恢复到反应前温度时,发现气球凹瘪,则抽滤瓶内溶液中的溶质是

A.NaOH与Na2CO3 B.Na2CO3
C.Na2CO3与NaHCO3 D.NaHCO3
查看答案和解析>>
科目: 来源:2013-2014学年上海市八校高三年级联合调研考试化学试卷(解析版) 题型:选择题
已知: ,
如果用丙烯与异戊二烯在该条件下反应,最多可以生成含六元环的化合物(不考虑立体异构)
,
如果用丙烯与异戊二烯在该条件下反应,最多可以生成含六元环的化合物(不考虑立体异构)
A.6种 B.4种 C.3种 D.2种
查看答案和解析>>
科目: 来源:2013-2014学年上海市八校高三年级联合调研考试化学试卷(解析版) 题型:选择题
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Mg2+、Al3+等离子。当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化如下图所示。由此可知原溶液中

A.不含SO42-
B.含有的阴离子一定是OH-、AlO2-、SiO32-
C.含有的阴离子一定是OH-、CO32-、AlO2-、SiO32-
D.含有AlO2-与SiO32-的物质的量之比为3:1
查看答案和解析>>
科目: 来源:2013-2014学年上海市八校高三年级联合调研考试化学试卷(解析版) 题型:选择题
已知二氯化二硫(S2Cl2)的结构式为Cl—S—S—Cl,它易与水反应2S2Cl2+2H2O→4HCl+SO2↑+3S↓。在该反应中
A.S2Cl2既作氧化剂又作还原剂
B.氧化产物与还原产物物质的量比为3:1
C.每生成22.4L SO2转移3mol电子
D.每生成48g硫会断裂6mol共价键
查看答案和解析>>
科目: 来源:2013-2014学年上海市八校高三年级联合调研考试化学试卷(解析版) 题型:选择题
已知25 ℃时有关弱酸的电离平衡常数:
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡 常数(25 ℃) |
1.8×l0-5 |
4.9×l0-10 |
K1=4.3×l0-7 K2=5.6×l0-11 |
由此可得出
A.对应钠盐溶液pH关系为: pH(Na2CO3) > pH(NaCN) > pH(CH3COONa)
B.CO2通入NaCN溶液中有:CO2+H2O+2NaCN→Na2CO3+2HCN
C.冰醋酸中逐滴加水,溶液的导电性、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-) +2c(CO32-)
查看答案和解析>>
科目: 来源:2013-2014学年上海市八校高三年级联合调研考试化学试卷(解析版) 题型:选择题
由短周期元素组成的常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去)。若
A.X是Na2CO3,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
B.A是单质,B和D的反应是OH-+HCO3-→H2O+CO32-,则E一定能还原Fe2O3
C.X是O2,且C与D摩尔质量相差16,则A一定为Mg3N2
D.D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
查看答案和解析>>
科目: 来源:2013-2014学年上海市八校高三年级联合调研考试化学试卷(解析版) 题型:选择题
298K温度下,CuSO4·5H2O脱水的平衡压力为:
|
化 学 反 应 |
p(H2O)/kPa |
|
|
|
|
(1)CuSO4·5H2O(s) |
1.04 |
|
(2)CuSO4·3H2O(s) |
0.75 |
|
(3)CuSO4·H2O(s) |
0.11 |
平衡关系表明:若p(H2O)>1.04kPa,CuSO4·5H2O不分解;p(H2O)=1.04kPa表明CuSO4·5H2O和CuSO4·3H2O处于平衡。则当
A.p(H2O)=0.75 kPa时,CuSO4·3H2O不分解
B.p(H2O)≤0.11 kPa时,CuSO4·H2O和CuSO4处于平衡
C.0.75kPa>p(H2O)>0.11kPa时,是CuSO4·H2O的稳定区
D.1.04kPa>p(H2O)>0.75kPa时,体系中不存在CuSO4·5H2O、CuSO4·H2O和CuSO4
查看答案和解析>>
科目: 来源:2013-2014学年上海市八校高三年级联合调研考试化学试卷(解析版) 题型:选择题
将a molNa2O2和b mol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应。当排出气体为两种气体时,a : b 的值不可能是
A.1:1 B.1:2 C.2:3 D. 3: 2
查看答案和解析>>
科目: 来源:2013-2014学年上海市八校高三年级联合调研考试化学试卷(解析版) 题型:选择题
NaNO2有像食盐一样的外观和咸味,它可将正常的血红蛋白变为高铁血红蛋
白,使血红蛋白中的铁元素由二价变为三价,失去携氧能力。
(1)美蓝是亚硝酸盐中毒的有效解毒剂,下列说法正确的是 。(选填编号)
A.解毒时美蓝表现氧化性 B.中毒时亚硝酸盐发生氧化反应
C.解毒时高铁血红蛋白被还原 D.中毒过程中血红蛋白显氧化性
(2)NaNO2中钠离子核外有 种不同能级的电子,三种元素对应的简单离子半径由大到小的顺序为 。
(3)Na、N、O分别与H形成的简单化合物中熔点最高的是 (填化合物化学式),试解释原因 。
(4)已知NaNO2 能发生如下反应(未配平):NaNO2 + HI → NO + I2 + NaI + H2O当有0.75mol HI被氧化时,在标准状况下产生气体的体积是_______L。
(5)有人将26中反应产生的NO收集到一个固定容积的密闭容器中,并在常温下将其压缩到1.01×107 Pa,然后加热至50℃时,发现气体的压力迅速下降。当温度恢复到常温,压强降至略小于1.01×107 Pa的2/3时,就不再改变。已知此过程中有一种产物是N2O。请写出生成N2O的反应方程式: 。
解释最后的气体压强略小于1.01×107 Pa的2/3原因: 。
(6)某工厂的废液中含有2%~5%的NaNO2直接排放会造成污染,下列试剂中①NaCl、②
NH4Cl、③HNO3、④浓H2SO4,能使NaNO2转化为N2的是 。(选填编号)
查看答案和解析>>
科目: 来源:2013-2014学年上海市八校高三年级联合调研考试化学试卷(解析版) 题型:填空题
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为
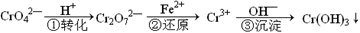
其中第①步存在平衡:2CrO42—(黄色)+2H+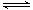 Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色。
(2)能说明第①步反应达平衡状态的是 。(选填编号)
A.Cr2O72—和CrO42—的浓度相同 B.v正 (Cr2O72—) =2v 逆(CrO42—)
C.溶液的颜色不变 D.溶液的pH值不变
(3)写出第②步中Cr2O72-转变为Cr3+的离子方程式: 。
(4)向Cr2(SO4)3溶液中,滴加NaOH,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的[Cr(OH)4]-离子。其平衡关系如下:

现向0.05mol·L-1的Cr2(SO4)3溶液50mL中,加入等体积0.6 mol·L-1的NaOH溶液,充分反应后,溶液中可观察到的现象为 ,溶液中离子浓度由大到小的顺序为 。
(5)在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以 形式存在(填写离子符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com