
科目: 来源: 题型:解答题
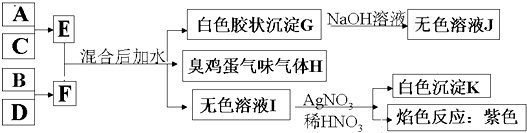
 2BO3,在一个固定容积为2L的密闭容器中充入0.20mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则v(o2 )=______mol?L-1?min-1.若继续通入0.20mol BO2和0.10mol O2,再次达到新平衡后,BO3的物质的量介于______之间.
2BO3,在一个固定容积为2L的密闭容器中充入0.20mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则v(o2 )=______mol?L-1?min-1.若继续通入0.20mol BO2和0.10mol O2,再次达到新平衡后,BO3的物质的量介于______之间.查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
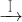
 CuSO4溶液
CuSO4溶液 CuSO4?5H2O…CuO
CuSO4?5H2O…CuO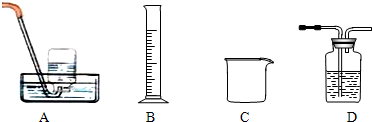
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 浓H2SO4有吸水性 | 浓H2SO4可用于干燥NH3 |
| B | SO2有漂白性 | SO2可使溴水的橙色褪去 |
| C | Mg有还原性 | 电解MgCl2饱和溶液可制备Mg |
| D | 锌金属性比铁强 | 海轮外壳上装锌块可减缓腐蚀 |
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com