
科目: 来源:2015届贵州省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列叙述中,能证明某物质是弱电解质的是
A、熔化时不导电
B、不是离子化合物,而是极性共价化合物
C、溶液中已电离的离子和未电离的分子共存
D、水溶液的导电能力很差
查看答案和解析>>
科目: 来源:2015届贵州省高二上学期期末考试化学试卷(解析版) 题型:选择题
将纯水加热到较高温度,以下叙述正确的是
A、水的离子积变大、pH变小、呈酸性
B、水的离子积不变、pH不变、呈中性
C、水的离子积变小、pH变大、呈碱性
D、水的离子积变大、pH变小、呈中性
查看答案和解析>>
科目: 来源:2015届贵州省高二上学期期末考试化学试卷(解析版) 题型:选择题
关于下列装置说法正确的是
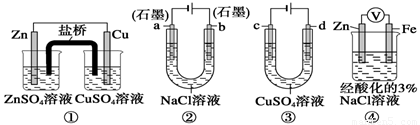
A、装置①中,盐桥中的K+移向ZnSO4溶液
B、装置②工作一段时间后,a极附近溶液的pH增大
C、用装置③精炼铜时,c极为粗铜
D、装置④中电子由Zn流向Fe,装置中有Fe2+生成
查看答案和解析>>
科目: 来源:2015届贵州省高二上学期期末考试化学试卷(解析版) 题型:填空题
氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式 。
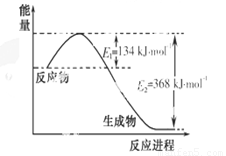
(2)已知:N2(g)+ O2(g)=2 NO(g) △H=+180 kJ • mol-1
2NO(g)+2 CO(g)=N2(g) + 2 CO2(g) △H=-746 kJ • mol-1
则反应CO(g) +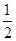 O2(g)=CO2(g)的 △H= kJ • mol-1。
O2(g)=CO2(g)的 △H= kJ • mol-1。
(3)在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:
N2(g)+3H2(g)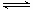 2NH3(g)
△H <0,
若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 。
2NH3(g)
△H <0,
若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 。
(4)在固定体积的密闭容器中,1.0×103 kPa时,发生反应 N2(g)+3H2(g)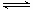 2NH3(g)
△H<0,其平衡常数K与温度T的关系如下表:
2NH3(g)
△H<0,其平衡常数K与温度T的关系如下表:
|
T/K |
298 |
398 |
498 |
|
平衡常数K |
51 |
K1 |
K2 |
① K1 K2(填写“>”、“=”或“<”)
②下列各项能说明上述合成氨反应一定达到平衡状态的是 (填字母)。
a、容器内N2、H2、NH3的浓度之比为1:3:2
b、NH3的浓度保持不变
c、容器内压强保持不变
d、混合气体的密度保持不变
查看答案和解析>>
科目: 来源:2015届贵州省高二上学期期末考试化学试卷(解析版) 题型:填空题
(1)25℃时,pH=12.0的KOH溶液中,由水电离出的C(OH-)=_______mol/L;pH=12.0的K2CO3溶液中,由水电离出来的C(OH-)=_______mol/L。
(2)常温下0.1mol·L-1 CH3COONa溶液PH=8
①用离子方程式表示CH3COONa溶液PH=8的原因:
②按物质的量浓度由大到小顺序排列该溶液中各种微粒(水分子除外)
(3)FeCl3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): , 实验室在配制FeCl3的溶液时,常将FeCl 3固体先溶于 中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解,否则得到的是浑浊的溶液。
查看答案和解析>>
科目: 来源:2015届贵州省高二上学期期末考试化学试卷(解析版) 题型:填空题
在一定体积的密闭容器中,进行化学反应CO2 (g)+H2 (g) CO
(g)+H2O (g),其化学平衡常数K和温度t的关系如下表:
CO
(g)+H2O (g),其化学平衡常数K和温度t的关系如下表:
|
t / ℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________。
(2)正反应为________反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是________(多选扣分)。
A、容器中压强不变 B、混合气体中c (CO)不变
C、v正(H2)=v逆(H2O) D、c (CO2)=c (CO)
(4)某温度下,平衡浓度符合下式:c (CO2)·c (H2)=c (CO)·c (H2O)。可判断此时的温度为________℃。
查看答案和解析>>
科目: 来源:2015届贵州省高二上学期期末考试化学试卷(解析版) 题型:填空题
如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:

(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的______棒。
②乙池中阳极的电极反应式是_______________________。
(2)若两池中均为饱和NaCl溶液:
①甲池中碳极上电极反应式是________________________,乙池碳极上电极反应属于____________(填“氧化反应”或“还原反应”)。
②将湿润的KI淀粉试纸放在乙池碳极附近,发现试纸变蓝,反应的化学方程式为_________。
③若乙池转移0.02 mol e-后停止实验,池中溶液体积是200 mL,则溶液混合匀后的pH=___。
查看答案和解析>>
科目: 来源:2015届贵州省高二上学期期末考试化学试卷(解析版) 题型:填空题
氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高。实验测得,在常温常压下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧热的化学方程式为 。
(2)氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ/mol
2NH3(g);ΔH=-92.4 kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。图中t1时引起平衡移动的条件可能是 其中表示平衡混合物中NH3的含量最高的一段时间是
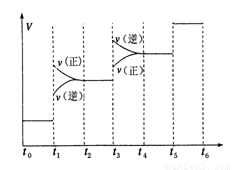
②温度为T ℃时,将2 a mol H2和a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为
查看答案和解析>>
科目: 来源:2015届贵州省高二上学期期末考试化学试卷(解析版) 题型:选择题
某酸式盐NaHY的水溶液c(OH-)>c(H+),下列叙述正确的是
A、H2Y的电离方程式:H2Y 2H+
+Y2-
2H+
+Y2-
B、HY-的水解方程式:HY- + H2O H3O+
+ Y2-
H3O+
+ Y2-
C、该酸式盐溶液中离子浓度关系:c(Na+)>c(HY-)>c(OH-)>c(H+)
D、该酸式盐溶液中离子浓度关系:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源:2015届贵州省高二上学期期末考试化学试卷(解析版) 题型:选择题
知:① 2C(已s)+O2(g) =2CO(g)
 H=
-221.0kJ/mmol
H=
-221.0kJ/mmol
②2H2(g)
+ O2(g) =2H2O(g)
 H= -483.6kJ/ol。
H= -483.6kJ/ol。
则制备水煤气的反应 C(s)
+H2O(g) = CO(g) + H2(g)的 H为
H为
A.+262.6kJ/mol B.-131.3kJ/mol C.-352.3kJ/mol D.+131.3kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com