
科目: 来源:2015届海南省三亚市高二上学期期中考试理科化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.物质的化学变化都伴随着能量变化
B.凡是吸热反应都需要加热
C.任何反应中的能量变化都表现为热量变化
D.拆开旧化学键吸收的能量一定大于形成新化学键放出的能量
查看答案和解析>>
科目: 来源:2015届海南省三亚市高二上学期期中考试理科化学试卷(解析版) 题型:选择题
下列有关“电离平衡”的叙述正确的是( )
A.电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度相等
B.电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是静态平衡
C.电离平衡是相对的、暂时的外界条件改变时,平衡就会发生移动
D.电解质达到电离平衡后,各种离子的浓度相等
查看答案和解析>>
科目: 来源:2015届海南省三亚市高二上学期期中考试理科化学试卷(解析版) 题型:选择题
在25℃和1.01×105Pa时,2N2O5(g)=4NO2(g) + O2(g);△H=+56.7kJ/mol,能自发进行的合理解释是( )
A.是吸热反应 B.是放热反应 C.是熵减反应 D.是熵增效应大于能量效应
查看答案和解析>>
科目: 来源:2015届海南省三亚市高二上学期期中考试理科化学试卷(解析版) 题型:选择题
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是 ( )
A.C(s)+ O2(g)=CO(g) ΔH=-393.5 kJ/mol
O2(g)=CO(g) ΔH=-393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(g) ΔH=+571.6 kJ/mol
C. C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1 400 kJ/mol
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1 400 kJ/mol
D.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ/mol
查看答案和解析>>
科目: 来源:2015届海南省三亚市高二上学期期中考试理科化学试卷(解析版) 题型:选择题
一定条件下,可逆反应C(s)+CO2(g)  2CO(g)
ΔH>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减小体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是 ( )
2CO(g)
ΔH>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减小体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是 ( )
A.①②③④ B.①③ C.①② D.①③④
查看答案和解析>>
科目: 来源:2015届海南省三亚市高二上学期期中考试理科化学试卷(解析版) 题型:选择题
制取水煤气的反应为C(s)+H2O(g)  CO(g)+H2(g) ΔH>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是
CO(g)+H2(g) ΔH>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是

A.加压 B.升温
C.增大水蒸气浓度 D.增大碳的物质的量
查看答案和解析>>
科目: 来源:2015届海南省三亚市高二上学期期中考试理科化学试卷(解析版) 题型:选择题
在一定条件下,已达平衡的可逆反应:2A(g)+B(g)  2C(g),下列说法中正确的是 ( )
2C(g),下列说法中正确的是 ( )
A.平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=
B.改变条件后,该反应的平衡常数K一定不变
C.如果改变压强并加入催化剂,平衡常数会随之变化
D.若平衡时增加A和B的浓度,则平衡常数会减小
查看答案和解析>>
科目: 来源:2015届海南省三亚市高二上学期期中考试理科化学试卷(解析版) 题型:选择题
已知下列反应的热化学方程式为
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
(2)C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
(3)H2(g)+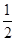 O2(g)=H2O(l)
ΔH3=-285.8 kJ/mol
O2(g)=H2O(l)
ΔH3=-285.8 kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的ΔH为( )
A.-488.3 kJ/mol B.-191 kJ/mol C.-476.8 kJ/mol D.-1 549.6 kJ/mol
查看答案和解析>>
科目: 来源:2015届海南省三亚市高二上学期期中考试理科化学试卷(解析版) 题型:选择题
工业生产水煤气的反应为:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.4 kJ/mol,下列判断正确的是( )
A.反应物能量总和小于生成物能量总和
B.CO(g)+H2(g)=C(s)+H2O(g) ΔH=+131.4 kJ/mol
C.水煤气反应中,生成1 mol H2(g)吸收131.4 kJ热量
D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量
查看答案和解析>>
科目: 来源:2015届海南省三亚市高二上学期期中考试理科化学试卷(解析版) 题型:选择题
下列关于强、弱电解质的叙述,有错误的是( )
A.强电解质在溶液中完全电离,不存在电离平衡
B.在溶液中,导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质
C.强电解质都是离子化合物,弱电解质都是共价化合物
D.纯净的强电解质在液态时,有的导电,有的不导电
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com