
科目: 来源:2015届海南三亚一中高二上学期期中考试理科化学试卷(B)(解析版) 题型:选择题
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应△H1、△H2、△H3的关系正确的是
A.△H1>△H2>△H3 B.△H1<△H3<△H2
C.△H1<△H2<△H3 D.△H1>△H3>△H2
查看答案和解析>>
科目: 来源:2015届海南三亚一中高二上学期期中考试理科化学试卷(B)(解析版) 题型:选择题
可逆反应N2O4 2NO2
△H>0在密闭容器中反应,达到平衡状态,要使混合气体颜色加深,可采取的方法是 ①减小压强 ②缩小体积③升高温度④增大N2O4的浓度 ( )
2NO2
△H>0在密闭容器中反应,达到平衡状态,要使混合气体颜色加深,可采取的方法是 ①减小压强 ②缩小体积③升高温度④增大N2O4的浓度 ( )
A.②③④ B.①②③ C.①③④ D.①②③④
查看答案和解析>>
科目: 来源:2015届海南三亚一中高二上学期期中考试理科化学试卷(B)(解析版) 题型:选择题
S(单斜)和S(正交)是硫的两种同素异形体。
已知:①S(单斜,s)+O2(g)=SO2(g) ΔH1=-297.16 kJ·mol-1
②S(正交,s)+O2(g)=SO2(g) ΔH2=-296.83 kJ·mol-1
③S(单斜,s)=S(正交,s) ΔH3
下列说法正确的是( )
A.ΔH3=+0.33 kJ·mol-1
B.单斜硫转化为正交硫的反应是吸热反应
C.S(单斜,s)=S(正交,s) ΔH3<0,正交硫比单斜硫稳定
D.S(单斜,s)=S(正交,s) ΔH3>0,单斜硫比正交硫稳定
查看答案和解析>>
科目: 来源:2015届海南三亚一中高二上学期期中考试理科化学试卷(B)(解析版) 题型:选择题
下列关于盐酸与醋酸两种稀溶液的说法正确的是 ( )
A.相同浓度的两溶液中c(H+)相同
B.100mL 0.1mol/L的两溶液能中和等物质的量的氢氧化钠
C.pH=3的两溶液都稀释10倍,盐酸的pH大于醋酸的PH
D.两溶液中分别加人少量对应的钠盐,c(H+)均明显减小
查看答案和解析>>
科目: 来源:2015届海南三亚一中高二上学期期中考试理科化学试卷(B)(解析版) 题型:选择题
在醋酸中存在电离平衡:CH3COOH  CH3COO-+H+,要使电离平衡右移且c(CH3COO—)增大,应采取的措施是 ( )
CH3COO-+H+,要使电离平衡右移且c(CH3COO—)增大,应采取的措施是 ( )
A.加入盐酸 B.加入NaOH(s) C.加蒸馏水 D.升高温度
查看答案和解析>>
科目: 来源:2015届海南三亚一中高二上学期期中考试理科化学试卷(B)(解析版) 题型:填空题
把煤作为燃料可通过下列两种途径:
途径I:C(s) +O2 (g) == CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s) +H2O(g) == CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2 (g) == 2CO2(g) △H3<0 ③
2H2(g)+O2 (g) == 2H2O(g) △H4<0 ④
请回答下列问题:
(1) 途径I放出的热量 ( 填“大于”“等于”或“小于”) 途径II放出的热量。
(2) △H1、△H2、△H3、△H4的数学关系式是 。
(3)12g 炭粉在氧气中不完全燃烧生成一氧化碳,放出110.35kJ热量。其热化学方程式为 。
(4)煤炭作为燃料采用途径II的优点有
查看答案和解析>>
科目: 来源:2015届海南三亚一中高二上学期期中考试理科化学试卷(B)(解析版) 题型:填空题
(14分)2SO2(g)+O2(g) 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
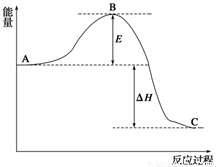
请回答下列问题:
(1)图中A、C分别表示__________、______________,E的大小对该反应的反应热有无影响?______________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?____________;
(2)图中ΔH=__________kJ/mol;
(3)如果反应速率v(SO2)为0.05 mol/(L·min),则v(O2)=________mol/(L·min)
(4)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH=_ _ 。
查看答案和解析>>
科目: 来源:2015届海南三亚一中高二上学期期中考试理科化学试卷(B)(解析版) 题型:填空题
研究NO2、、CO等大气污染气体的处理具有重要意义。
利用反应6NO2(g)+8NH3(g)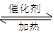 7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3, 反应过程中测定的部分数据见下表
7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3, 反应过程中测定的部分数据见下表
|
反应时间/min |
n(NO2)/mol |
n(NH3)/ mol |
|
0 |
1.20 |
1.60 |
|
2 |
0.90 |
|
|
4 |
|
0.40 |
(1)反应在2min内的平均速率为v(NH3)= ,4min该反应达到平衡状态,则该反应的平衡常数K的表达式为 ,NO2的转化率为
(2)700℃ ,将NO2与NH3以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.体系密度保持不变
d.每消耗1 mol NO2的同时生成2 mol H2O
查看答案和解析>>
科目: 来源:2015届海南三亚一中高二上学期期中考试理科化学试卷(B)(解析版) 题型:填空题
为了证明醋酸是弱电解质,甲、乙、丙、丁四人分别选用下列试剂进行实验:
0.10mol/L醋酸溶液、pH=3的盐酸、pH=3的醋酸、NaAC晶体、NaCL晶体、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.10mol/L的醋酸溶液pH=4,则认定醋酸是弱电解质,你认为这一方法正确吗?(填“正确”或“不正确”)
(2)乙取出10ml0.10mol/L的醋酸溶液,用pH试纸测出其pH=a,然后用蒸馏稀释到1000mL,在用pH试纸测定其pH=b,要确定醋酸是弱电解质,则a、b应该满足的关系是 (用“等式”或“不等式”表示)
(3)丙将pH=3醋酸和盐酸,各取10ml,用蒸馏水稀释到原来的100倍,然后用pH试纸测定该溶液的pH,醋酸的变化小,则认定醋酸是弱电解质,你认为这一方法正确吗?
(填“正确”或“不正确”)
(4)丁将pH=3醋酸和盐酸,分别加入相应的钠盐固体,醋酸的PH变化大,则认定醋酸是弱电解质,你认为这一方法正确吗?(填“正确”或“不正确”) 。
(5)戊取pH=3的盐酸和醋酸,分别稀释到原来的100倍,然后加入完全一样的锌粒,醋酸放出H2的速率快,则认定醋酸是弱电解质,你认为这一方法正确吗?(填“正确”或“不正确”) 。
查看答案和解析>>
科目: 来源:2015届海南三亚一中高二上学期期中考试理科化学试卷(B)(解析版) 题型:实验题
50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”),简述理由: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com