
科目: 来源:2015届江苏省高二上学期期中考试化学试卷(选修)(解析版) 题型:选择题
水的电离过程为H2O H++OH-,在不同温度下离子积为KW(25℃)=1.0×10-14,
H++OH-,在不同温度下离子积为KW(25℃)=1.0×10-14,
KW(35℃)=2.1×10-14。则下列叙述正确的是
A.c(H+)随温度的升高而降低 B.35℃时,c(H+)>c(OH-)
C.氯化钠溶液中KW (35℃) <KW (25℃) D.水的电离是吸热的过程
查看答案和解析>>
科目: 来源:2015届江苏省高二上学期期中考试化学试卷(选修)(解析版) 题型:选择题
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是

A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目: 来源:2015届江苏省高二上学期期中考试化学试卷(选修)(解析版) 题型:选择题
对于可逆反应2HI(g)  I2(g)+H2(g),下列叙述能够说明已达到平衡状态的是
I2(g)+H2(g),下列叙述能够说明已达到平衡状态的是
A.各物质的量的浓度比2 : 1: 1
B.容器内的总压不随时间变化
C.生成2 mol H-I键的同时生成1 mol I-I键
D.混合气体的颜色不再变化时
查看答案和解析>>
科目: 来源:2015届江苏省高二上学期期中考试化学试卷(选修)(解析版) 题型:选择题
电解法精炼含有Fe、Zn、Ag等杂质的粗铜。下列叙述正确的是
A.电解时以硫酸铜溶液作电解液,精铜作阳极
B.粗铜与电源负极相连,发生氧化反应
C.阴极上发生的反应是Cu2++2e-=Cu
D.电解后Fe、Zn、Ag等杂质会沉积在电解槽底部形成阳极泥
查看答案和解析>>
科目: 来源:2015届江苏省高二上学期期中考试化学试卷(选修)(解析版) 题型:选择题
某密闭容器中发生如下反应:2X(g)+Y(g)  Z(g);△H <0 下图表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5
时刻外界条件有所改变,但都没有改变各物质的用量。则下列说法中不正确的是
Z(g);△H <0 下图表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5
时刻外界条件有所改变,但都没有改变各物质的用量。则下列说法中不正确的是

A.t3 时减小了压强
B.t5 时增大了压强
C.t6 时刻后反应物的转化率最高
D.t1 - t2 时该反应的平衡常数大于t6 时反应的平衡常数
查看答案和解析>>
科目: 来源:2015届江苏省高二上学期期中考试化学试卷(选修)(解析版) 题型:填空题
电离度表示电解质的相对强弱,电离度的定义:
α=(已电离的电解质分子数/溶液中原有电解质的总分子数)×100%。
已知25℃时几种物质(微粒)的电离度(溶液浓度均为0.1 mol·L-1)如下表:
编号 物质(微粒) 电离度α
A 硫酸溶液(第一步完全电离): 第二步 HSO4- H++SO42- 10%
H++SO42- 10%
B 硫酸氢钠溶液: HSO4- H++SO42 29%
H++SO42 29%
C 醋酸: CH3COOH CH3COO-+H+ 1.33%
CH3COO-+H+ 1.33%
D 盐酸: HCl=H++Cl- 100%
(1)25℃时,0.1 mol·L-1上述几种溶液中,c(H+)从大到小的顺序是 (填序号);
(2)25℃时,0.1 mol·L-1硫酸溶液中HSO4-的电离度小于相同温度下0.1 mol·L-1硫酸氢钠
溶液中HSO4-的电离度,其原因是 。
(3)醋酸的电离平衡常数K的表达式是 ,醋酸的电离平衡常数
K与电离度α的关系式为:K= (用含α的代数式表示)
查看答案和解析>>
科目: 来源:2015届江苏省高二上学期期中考试化学试卷(选修)(解析版) 题型:填空题
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所示实验装置可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
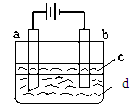
(1)b电极材料为______,其电极反应式为_____________________。
(2)(选择填空)电解时,当在电极上有白色沉淀生成时,电解液d是_____;当在两极之间的溶液中有白色沉淀生成时,电解液d是______。
A.纯水 B.NaCl溶液 C. NaOH溶液 D.CuCl2溶液
(3)液体c为苯,其作用是________________,在加入苯之前,对d溶液进行加热处理的目的是_______________________。
(4)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为_________________________________。该现象的化学反应方程式为
查看答案和解析>>
科目: 来源:2015届江苏省高二上学期期中考试化学试卷(选修)(解析版) 题型:实验题
下面是某研究小组研究的关于不同催化剂对H2O2 分解反应的催化效率。
|
催化剂(0.1g) |
活性炭 |
FeCl3 |
KI |
MnO2颗粒状 |
MnO2粉末状 |
|
前15s产生氧气的量(ml) |
5 |
11 |
7 |
8 |
11 |
|
前30s产生氧气的量(ml) |
8 |
16 |
11 |
11 |
21 |
|
前45s产生氧气的量(ml) |
11 |
20 |
15 |
18 |
35 |
|
前60s产生氧气的量(ml) |
15 |
24 |
20 |
26 |
49 |
(1)写出H2O2 在催化剂作用下分解反应的化学方程式________________________
(2)从上表可以得出:活性炭、FeCl3、KI 和MnO2(粉末状)几种催化剂中,催化效率由大到小的顺序是_____________________,
等质量的固体催化剂,颗粒大小对催化效率有什么影响______________________
(3)实验发现新鲜的动物肝脏对H2O2 的分解也有显著的催化作用,但当往溶液中加入
盐酸,或给溶液加热时,就会失去催化能力,合理的解释是
(4)对于FeCl3的催化作用,有人认为是Fe3+起催化作用,有人认为是Cl-,请你设计一
个实验进行验证。_______________________________________________________
查看答案和解析>>
科目: 来源:2015届江苏省高二上学期期中考试化学试卷(选修)(解析版) 题型:填空题
完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:
(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s);△H=-169kJ·mol-1,
C(s)+1/2O2(g)=CO(g);△H=-110.5kJ·mol-1,
Cu(s)+1/2O2(g)=CuO(s);△H=-157kJ·mol-1
用炭粉在高温条件下还原CuO生成Cu2O的热化学方程式是:
(2)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) 2SO3(g),写出该反应的化学平衡常数表达式:
2SO3(g),写出该反应的化学平衡常数表达式:
(3)以甲烷、空气为反应物,KOH溶液作电解质溶液构成燃料电池,则负极反应式为: 。
(4)铁在潮湿的空气中发生吸氧腐蚀的电池反应方程式为 。
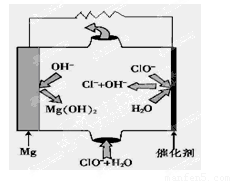
(5)“镁—次氯酸盐”燃料电池,其装置示意图如图,该电池反应的总反应方程式为_______________ 。
(6)工业上电解熔融氯化钠的方程式为 。
查看答案和解析>>
科目: 来源:2015届江苏省高二上学期期中考试化学试卷(选修)(解析版) 题型:计算题
某温度下,在一固定容积的密闭容器中投入一定物质的量的N2与H2进行可逆反应:N2(g)+3H2(g)
 2NH3(g)
在2 min时达到平衡状态,此时c(N2)=5.00 mol/L,c(H2)=10.00mol/L,c(NH3)=5.00 mol/L。试求:(写出解题过程)
2NH3(g)
在2 min时达到平衡状态,此时c(N2)=5.00 mol/L,c(H2)=10.00mol/L,c(NH3)=5.00 mol/L。试求:(写出解题过程)
(1)该温度下,反应的平衡常数是多少?
(2)H2的起始浓度;
(3)用N2表示该反应的反应速率是多少;
(4)N2的转化率(保留三位有效数字);
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com