
科目: 来源: 题型:单选题
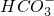 离子
离子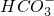 浓度为0.1mol/L
浓度为0.1mol/L查看答案和解析>>
科目: 来源: 题型:解答题
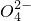 容易转化为Fe2+,某反应体系中共存在下列6种粒子:Fe2
容易转化为Fe2+,某反应体系中共存在下列6种粒子:Fe2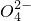 、Fe2+、H+、H2O、Cu2O、Cu2+,则该反应中的氧化剂是______,还原剂是______.
、Fe2+、H+、H2O、Cu2O、Cu2+,则该反应中的氧化剂是______,还原剂是______.查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
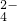 .请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).提出合理假设.
.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).提出合理假设.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com