
科目: 来源:2015届广东省高二上学期期中考试理科化学试卷(解析版) 题型:选择题
下列各式中,属于正确的电离方程式的是
A.HCO3- = CO32- + H+ B.HCO3- +OH- = H2O + CO32-
C.NH3 +
H+ = NH4+
D.NH3·H2O  NH4+ + OH-
NH4+ + OH-
查看答案和解析>>
科目: 来源:2015届广东省高二上学期期中考试理科化学试卷(解析版) 题型:选择题
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) Z(g)+W(s) ΔH>0
Z(g)+W(s) ΔH>0
下列叙述正确的是
A.加入少量W,逆反应速率增大 B.当容器中气体的密度不变时,反应达到平衡
C.升高温度,Y的百分含量增加 D.平衡后加入X,上述反应的ΔH增大
查看答案和解析>>
科目: 来源:2015届广东省高二上学期期中考试理科化学试卷(解析版) 题型:选择题
从下列事实所得出的解释或结论正确的是
选项 实验事实 解释或结论
A 2N2O5(g) 4NO2(g)+O2(g) ΔH>0
4NO2(g)+O2(g) ΔH>0
在室温下能自发进行 这是一个熵增的反应
B 压缩针筒内的NO2和N2O4混合气体,
颜色先变深后变浅 增大压强,平衡向生成N2O4的方向移动,新平衡比旧平衡压强小
C 锌与稀硫酸反应过程中,开始反应后速率逐渐增大 该反应是放热反应
D 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 反应物的浓度一定降低
查看答案和解析>>
科目: 来源:2015届广东省高二上学期期中考试理科化学试卷(解析版) 题型:选择题
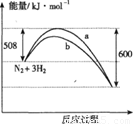
在容积固定不变的密闭容器中加入1 mol N2和3 mol H2发生反应,下列叙述正确的是
A.该反应的热化学方程式为:
N2+3H2 2NH3 ΔH =-92 kJ·mol-1
2NH3 ΔH =-92 kJ·mol-1
B.达到平衡后向容器中通入1 mol氦气,平衡不移动
C.降低温度和缩小容器体积均可使该反应的平衡常数增大
D.图中曲线b表示使用了催化剂
查看答案和解析>>
科目: 来源:2015届广东省高二上学期期中考试理科化学试卷(解析版) 题型:选择题
在水溶液中,重铬酸钾K2Cr2O7存在以下平衡:

 ,下列说法正确的是
,下列说法正确的是
A.向该溶液中加入过量浓NaOH溶液后,溶液呈橙红色
B.该反应不是氧化还原反应
C.向该溶液中滴加适量的浓硫酸,平衡向逆反应方向移动,再次达到平衡后,氢离子浓度比原溶液大
D.该反应的平衡常数表达式是
查看答案和解析>>
科目: 来源:2015届广东省高二上学期期中考试理科化学试卷(解析版) 题型:选择题
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g)
,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是
CH3OH(g)
,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是

A.该反应的△H<0
B.其他条件不变,升高温度反应的平衡常数增大
C.300℃时,0-t 1min内 CH3OH的平均生成速率为 mol·L-1 min-1
mol·L-1 min-1
D.A点的反应体系从300℃升高到500℃,达到平衡时 减小
减小
查看答案和解析>>
科目: 来源:2015届广东省高二上学期期中考试理科化学试卷(解析版) 题型:填空题
KI溶液在酸性条件下能与氧气反应。 现有以下实验记录:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
温度(℃) |
30 |
40 |
50 |
60 |
70 |
|
显色时间(s) |
160 |
80 |
40 |
20 |
10 |
回答下列问题:
(1)该反应的离子方程式为 。
(2)该实验的目的是 。
(3)实验试剂除了1 mol/L KI溶液、0.1 mol/L H2SO4溶液外,还需要的试剂是 ,实验现象为 。
(4)上述实验操作中除了需要(3)的条件外,还必须控制不变的是 (填字母)。
A.温度 B.试剂的浓度 C.试剂的用量(体积) D.试剂添加的顺序
(5)由上述实验记录可得出的结论是 。
(6)若要进行酸性对反应速率的影响的探究实验,你会采取的措施是 。
查看答案和解析>>
科目: 来源:2015届广东省高二上学期期中考试理科化学试卷(解析版) 题型:填空题
常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为kJ.mol-1)下表是一些键能数据(kJ·mol-1)
|
化学键 |
键能 |
化学键 |
键能 |
化学键 |
键能 |
|
C-F |
427 |
C-Cl |
330 |
C-I |
218 |
|
H-H |
436 |
S=S |
255 |
H-S |
339 |
回答下列问题:
(1)由表中数据规律预测C-Br键的键能范围:_________ <C-Br键能<__________ (回答数值和单位)
(2)热化学方程式2H2(g)+S2(g) =2H2S(g);△H= QkJ·mol-1;则Q=
(3) 已知下列热化学方程式:
O2 (g) = O+2(g) + e—
 H1= +1175.7 kJ·mol-1
H1= +1175.7 kJ·mol-1
PtF6(g) + e—= PtF6—(g)
 H2= —771.1 kJ·mol-1
H2= —771.1 kJ·mol-1
O2+PtF6—(s)
= O2+(g) + PtF6—(g)  H3= +482.2 kJ·mol-1
H3= +482.2 kJ·mol-1
则反应O2(g)
+ (g)
= O2+PtF6— (s)  H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
查看答案和解析>>
科目: 来源:2015届广东省高二上学期期中考试理科化学试卷(解析版) 题型:填空题
氯气在298K、100kPa时,在1L水中可溶解0.090mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为____________________________;
(2)根据离子方程式,计算该反应的平衡常数(水视为纯液体,列式计算,保留2位有效数字)
(3)在上述平衡体系中加入少量NaOH固体,平衡将向________移动;(填“正”、“逆”或“不”)
(4)如果增大氯气的压强,氯气在水中的溶解度将______(填“增大”、“减小”或“不变”),平衡将向______________移动。(填“正”、“逆”或“不”)
(5)新制氯水经光照一段时间后溶液c(H+)增大,请运用平衡移动原理进行解释:__________________。
查看答案和解析>>
科目: 来源:2015届广东省高二上学期期中考试理科化学试卷(解析版) 题型:填空题
在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:
2SO2(g)+O2(g) 2SO3(g)
ΔH=-92.3KJ/mol,反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为0.1MPa):
2SO3(g)
ΔH=-92.3KJ/mol,反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为0.1MPa):
|
时间min |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
n(SO2) |
2.00 |
1.92 |
1.84 |
1.76 |
1.76 |
1.64 |
1.52 |
1.40 |
1.40 |
1.40 |
|
n(O2) |
1.00 |
0.96 |
0.92 |
0.88 |
0.88 |
0.82 |
0.76 |
0.70 |
0.70 |
0.70 |
|
n(SO3) |
0 |
0.08 |
0.16 |
0.24 |
0.24 |
0.36 |
0.48 |
0.60 |
0.60 |
0.60 |
回答下列问题:
(1)___________________________时段,反应处于平衡状态。
(2)第5min时,从同时提高速率和转化率两个方面分析,改变的外界条件是_____________;平衡向____________方向移动。(填“正”、“逆”或“不”)
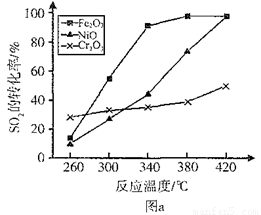
(3)其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图a。,Fe2O3和NiO作催化剂均能使S02的转化率达到最高,不考虑价格因素,选择Fe2O3的 主要优点是_____________。
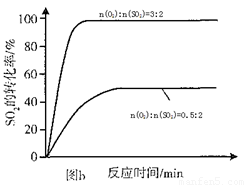
(4)科研小组在3800C Fe2O3作催化剂时,研究了不同投料比n(O2):n(SO2)对S02转化率的影响,结果如图b。请在答题卡坐标图中画出n(O2):n(SO2)=1:2时,SO2转化率的预期变化曲线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com