
科目: 来源:2015届广东省广州市四校高二上学期期末联考化学试卷(解析版) 题型:选择题
在容积可变的密闭容器中存在如下反应:2A(g)+B(g) 3C(g) ΔH<0,某研究小组研究了其他条件不变时,只改变某一条件对上述反应的影响,下列分析正确的是( )
3C(g) ΔH<0,某研究小组研究了其他条件不变时,只改变某一条件对上述反应的影响,下列分析正确的是( )

A.图Ⅰ表示的是t1时刻升高温度对反应速率的影响
B.图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响
C.图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高
D.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高
查看答案和解析>>
科目: 来源:2015届广东省广州市四校高二上学期期末联考化学试卷(解析版) 题型:选择题
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
A.放电时负极附近溶液的pH不变
B.放电时电解质溶液中的OH-向正极移动
C.充电时电池的负极应与电源的负极相连接
D.充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O
查看答案和解析>>
科目: 来源:2015届广东省广州市四校高二上学期期末联考化学试卷(解析版) 题型:选择题
常温下,有下列四种溶液:
|
① |
② |
③ |
④ |
|
0.1mol/L NH3·H2O溶液 |
pH=11 NaOH溶液 |
pH=1 H2SO4溶液 |
pH=3 CH3COOH溶液 |
下列说法正确的是( )
A.①与③等体积混合,溶液pH<7
B.②与④等体积混合,溶液pH>7
C.将VmL④的溶液浓缩到10—2VmL后,pH与③相同
D.②与③混合,若溶液pH=7,则V(NaOH) : V(H2SO4) =100 : 1
查看答案和解析>>
科目: 来源:2015届广东省广州市四校高二上学期期末联考化学试卷(解析版) 题型:选择题
已知25℃时:
① NH4+ (aq) 十OH—(aq)=NH3·H2O(aq) ΔH=a kJ·mol-1
② NH4+
(aq) 十H2O(1)  NH3·H2O(aq)十H+(aq) ΔH=bkJ·mol-1
NH3·H2O(aq)十H+(aq) ΔH=bkJ·mol-1
向20 mL0.1mol/L氨水中逐滴加入0.1mol/L盐酸,下列有关说法正确的是( )
A.随着盐酸的逐滴加入,水电离的c(OH—)总是逐渐减小
B.当滴入10mL盐酸时,溶液中:c(NH4+)十c(NH3·H2O)=2c(Cl—)
C.当滴入20mL盐酸时,溶液中:c(Cl—)十c(H+)=c(NH4+)十c(OH—)
D.水电离过程的热化学方程式可表示为:H2O(1)
 H+(aq)+OH—(aq) ΔH=( b-a) kJ·mol-1
H+(aq)+OH—(aq) ΔH=( b-a) kJ·mol-1
查看答案和解析>>
科目: 来源:2015届广东省广州市四校高二上学期期末联考化学试卷(解析版) 题型:选择题
反应N2O4(g)
 2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )

A.A、B两点的反应速率:A>B
B.B、C两点的反应平衡常数相同
C.由状态B到状态C,可以用加热的方法
D.A、C两点混合气体的平均相对分子质量:C>A
查看答案和解析>>
科目: 来源:2015届广东省广州市四校高二上学期期末联考化学试卷(解析版) 题型:选择题
25°C时某些弱酸的电离平衡常数如下表,下列说法正确的是( )
|
化学式 |
CH3COOH |
HClO |
H2CO3 |
|
Ka |
Ka=1.8×10-5 |
Ka=3.0×10-8 |
Ka1=4.1×10-7 Ka2=5.6×10-11 |
A.等物质的量浓度溶液酸性由强到弱的顺序为:H2CO3>CH3COOH>HClO
B.等物质的量浓度溶液pH由大到小的顺序为:Na2 CO3>NaClO>NaHCO3>CH3COONa
C.等物质的量浓度的NaClO和NaHCO3 混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.向次氯酸钠溶液中通入少量二氧化碳气体的离子方程式为:ClO—+CO2+H2O=CO32—+2HClO
查看答案和解析>>
科目: 来源:2015届广东省广州市四校高二上学期期末联考化学试卷(解析版) 题型:填空题
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)  CH3OH(g)。
CH3OH(g)。


(1)图1是表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)= ; H2的平衡转化率为_________________________。
(2)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。写出反应的热化学方程式 。
(3)该温度下,反应平衡常数K=______________(填数值),温度升高,平衡常数K_________(填“增大”、“不变”或“减小”)。
(4)恒容条件下,下列措施中能使反应体系中  增大的措施有
。
增大的措施有
。
a.升高温度 b.充入He气 c.再充入2 molH2 d.使用催化剂
查看答案和解析>>
科目: 来源:2015届广东省广州市四校高二上学期期末联考化学试卷(解析版) 题型:填空题
金属铜不溶于稀硫酸,但可溶于铁盐溶液。现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)。
(1)写出铜溶解于上述混合溶液的离子方程式_______________________________________。
(2)若铜完全溶解时,溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶解铜的质量是_________g,溶液中的c(SO42—)=__________mol/L。
(3)若欲在如图所示的装置中发生(1)中的反应,则:X极是 (正、负极),电极反应式 。Y极的材料是 ,电极反应式 。
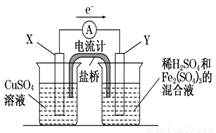
查看答案和解析>>
科目: 来源:2015届广东省广州市四校高二上学期期末联考化学试卷(解析版) 题型:填空题
在常温下向20mL 0.1 mol·L-1 某酸(用HAc表示)溶液中逐滴加入0.1 mol·L-1 NaOH溶液,用pH计来测定溶液中pH数据如下表,作出pH与NaOH溶液体积关系的曲线如图所示(忽略温度变化)。请根据表中数据和滴定曲线回答以下问题:
|
V(NaOH)mL |
0.00 |
10.00 |
18.00 |
19.80 |
19.98 |
20.00 |
20.02 |
20.20 |
22.00 |
40.00 |
|
pH |
3.0 |
4.7 |
5.7 |
6.7 |
7.7 |
8.7 |
9.7 |
10.7 |
11.7 |
12.5 |
(1)实验中的指示剂最好使用___________________________;
(2)当V (NaOH)=20.00mL时,请写出溶液中主要存在的两种平衡状态的表示式_______________、________________;溶液中离子浓度由大到小的顺序是___________________;
(3)a、b、c、d四点对应溶液中水的电离程度由大到小的顺序是_________________。
(4)该温度下,滴定曲线上c点时HAc的电离平衡常数Ka=_______(用含V的代数简式表示)。

查看答案和解析>>
科目: 来源:2015届广东省广州市四校高二上学期期末联考化学试卷(解析版) 题型:实验题
某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入高锰酸钾溶液时,溶液褪色先慢后快,即反应速率由小变大。小组成员为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种,并为此设计实验进行探究验证。
猜想Ⅰ:此反应过程放热,温度升高,反应速率加快;
猜想Ⅱ:……。
【实验目的】探究草酸与高锰酸钾反应的速率变化“异常”原因
【实验用品】仪器:试管、胶头滴管、量筒、药匙、玻璃棒等;
试剂:0.1mol/L H2C2O4溶液、0.05mol/L KMnO4(硫酸酸化)溶液等。
请你根据该兴趣小组的实验探究设计思路,补充完整所缺内容。
(1)草酸(H2C2O4,弱酸)与酸性KMnO4溶液反应的离子方程式为(已知:MnO4_还原产物是Mn2+) 。
(2)要完成对猜想Ⅰ的实验验证,至少还需要一种实验仪器是 。
(3)猜想Ⅱ可能是______________________________________________________________。要设计实验验证猜想Ⅱ,进行该实验还要补充一种试剂及一种仪器,分别是 。
(4)基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容。
|
|
试管A |
试管B |
|
加入试剂 |
|
|
|
(预期)实验现象 (褪色时间) |
|
|
|
结论 |
猜想Ⅱ正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com