
科目: 来源:2015届广东省佛山市质量检测化学试卷(解析版) 题型:选择题
下列事实可证明一水合氨是弱电解质的是
A.0.1mol/L的氨水可使酚酞试液变红
B.0.1mol/L的氯化铵溶液的pH约为5
C.在相同条件下,氨水溶液的导电性比强碱溶液弱
D.铵盐受热易分解
查看答案和解析>>
科目: 来源:2015届广东省佛山市质量检测化学试卷(解析版) 题型:选择题
下列各溶液中,物质的量浓度关系正确的是
A.0.1 mol•L—1的KAl(SO4)2溶液中:c(SO42—)>c(K+)>c(A13+)>c(H+)>c(OH—)
B.10mL0.01mo1•L—1HCl溶液与10mL0.01mo1•L—1Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12
C.在01mo1•L—1CH3COONa溶液中,c(OH—)=c(CH3COOH)+c(H+)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液,若溶液呈酸性,则有c(Na+)>c(HX)>c(X—)>c(H+)>c(OH—)
查看答案和解析>>
科目: 来源:2015届广东省佛山市质量检测化学试卷(解析版) 题型:选择题
下列有关热化学方程式的叙述中,正确的是
A.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)=NaC1(aq)+H2O(1) ΔH=+57.4kJ/mo1
B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则石墨比金刚石稳定
C.已知2H2(g)+O2(g)=2H2O(g) ΔH =—483.6kJ/mol,则H2燃烧热为241.8kJ/mol
D.己知2C(s)+2O2(g)=2CO2(g) ΔH 1;2C(s)+O2(g)=2CO(g) ΔH 2;则ΔH 1<ΔH 2
查看答案和解析>>
科目: 来源:2015届广东省佛山市质量检测化学试卷(解析版) 题型:选择题
下列实验装置(部分固定装置略去)和有关叙述正确的是
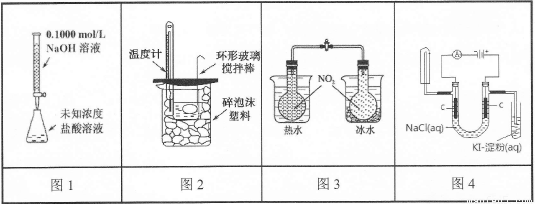
A.图1可以进行酸碱中和滴定实验
B.图2可以进行中和热的测定实验
C.图3可验证温度对化学平衡的影响
D.图4可检验食盐水通电后的部分产物
查看答案和解析>>
科目: 来源:2015届广东省佛山市质量检测化学试卷(解析版) 题型:选择题
T℃时在2L刚性密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为Tl和T2时,Y的体积分数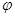 (Y)与时间的关系如图2所示。则下列结论错误的是
(Y)与时间的关系如图2所示。则下列结论错误的是
A.容器中发生的反应可表示为:3X(g)+Y(g) 2Z(g)
2Z(g)
B.反应进行的前4min内,用X表示的反应速率v(X)=0.15mo1•(L•min)—1
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂
查看答案和解析>>
科目: 来源:2015届广东省佛山市质量检测化学试卷(解析版) 题型:填空题
(1)在101kPa下,CH4(g)、H2(g)、C(s)的燃烧热分别为890.3kJ•mo1—1、285.8kJ•mo1—1和393.5kJ•mo1—1,则反应C(s)+2H2(g)=CH4(g)的反应热ΔH= 。
(2)已知:2H2(g)+O2(g)=2H2O(g) ΔH1
2H2(g)+O2(g)=2H2O(l) ΔH2
2CO(g)+O2(g)=2CO2(g) ΔH3
①液态水转化为气态水的热化学方程式为 。
②CO和H2分别燃烧生成CO2 (g)和H2O(g),欲得到相同热量,所需CO和H2的体积比是 。
查看答案和解析>>
科目: 来源:2015届广东省佛山市质量检测化学试卷(解析版) 题型:实验题
某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。
(1)该实验应选用 作指示剂,量取一定体积的白醋所用的仪器是 。
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL。

(3)为了减小实验误差,该同学一共进行了3次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为cmo1/L,3次实验结果记录如下:
|
实验次数 |
第一次 |
第二次 |
第三次 |
|
消耗NaOH溶液体积/mL |
26.02 |
25.35 |
25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是( )
A.初读正确,实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水洗净,未用标准液润洗
D.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)白醋溶液中存在的电离平衡为 (用电离平衡方程式表示)。
(5)在滴定过程中,当c(CH3COOˉ)>c(Na+)时,则混合溶液呈____(填序号)。
A.酸性 B.碱性 C.中性 D.无法确定
(6)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):c= 。
查看答案和解析>>
科目: 来源:2015届广东省佛山市质量检测化学试卷(解析版) 题型:填空题
在80℃时,将0.40mo1的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4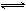 2NO2
△H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2
△H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
t/s n/mol |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)计算0~20s内用NO2表示的平均反应速率为 mo1•L—1•s—1。
(2)计算在80℃时该反应的平衡常数K= (请注明单位)。
(3)反应进行至100s后将反应混合物的温度升高,混合气体的颜色 (填“变浅”“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有 (填序号)。
A.增大N2O4的起始浓度
C.使用高效催化剂
B.向混合气体中通入NO2
D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出(不用计算,定性处理)该反应在60℃时N2O4物质的量的变化曲线。

查看答案和解析>>
科目: 来源:2015届广东省佛山市质量检测化学试卷(解析版) 题型:填空题
(1)室温下在pH=12的NaCN溶液中,由水电离的c(OH—)为 mol•L—1。
(2)浓度为0.1mol•L—1的下列各物质的溶液中,c(NH4+)由大到小的顺序是___(填序号)。
①NH4Cl ②NH4HSO4 ③NH3•H2O ④CH3COONH4
(3)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A=H+ +HA—,HAˉ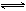 H+
+A2—。
H+
+A2—。
①则Na2A溶液显____性;NaHA溶液显 性(填“酸性”、“中性”或“碱性”)。
②若有0.1mo1•L—1Na2A的溶液,其中各种离子浓度由大到小的顺序是: (填序号)。
A.c(Na+)>c(A2—)>c(OH—)>c(HA—)>c(H+)
B.c(Na+)> c(OH—)>c(HA—)> >c(A2—) > c(H+)
C.c(Na+)> c(H+)> c(A2—)> c(OH—)>c(HA—)
D.c(A2—)>c(Na+)> c(OH—) > c(H+)>c(HA—)
(4)在含有Cl—、Br—、I—的溶液中,已知其浓度均为0.1mo1/L,已知AgCl、AgBr、AgI的溶度积分别为1.6×10—10、4.l×10—15、1.5×10—16,若向混合溶液中逐滴加入AgNO3溶液,试回答:
①当AgBr沉淀开始析出时,溶液中Ag+浓度是 。
②当AgC1沉淀开始析出时,溶液中的Br—、I—是否完全沉淀 (当溶液中离子浓度小于1.0×10—5mo1/L时,认为已经沉淀完全,本空选填“是”或“否”)。
查看答案和解析>>
科目: 来源:2015届广东省佛山市质量检测化学试卷(解析版) 题型:填空题
迄今为止,由化学能转变的热能或电能仍然是人类使用的主要的能源。
I.请仔细观察下列两种电池的构造示意图,完成下列问题:
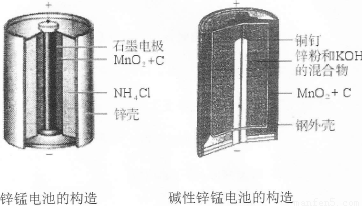
(1)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析其原因是 。
(2)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极的电极反应式为 。
Ⅱ.下面是一个将化学能与电能相互转化的装置。回答下列问题:
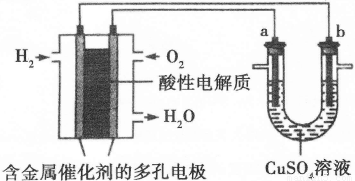
(1)写出通入O2一极的电极反应方程式为 。
(2)a电极是 极,能否写出其电极反应方程式 (填“能”或“不能”),若“能”写出其电极反应方程式,若“不能”说明其理由 。
(3)下列说法不正确的是( )
A.此装置用于电镀铜时,电解一段时间,硫酸铜溶液的浓度不变
B.U型管中,OH—在a极放电
C.若a为纯净金属,b为粗制金属,该装置可用于粗制金属的精炼
D.电子经导线流入b电极
Ⅲ.某同学运用所学知识,自选材料设计实验,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑。请在下面框中画出能够实验这一反应的装置图,并在图中进行必要的标注。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com