
科目: 来源:2015届安徽省高二上学期期中考试化学试卷(解析版) 题型:选择题
反应N2O4(g)
 2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是 ( )
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是 ( )

A.a、c两点的反应速率:a>c
B.a、c两点气体的颜色:a深,c浅
C.b、c两点的平衡常数:b<c
D.a、c两点气体的平均相对分子质量:a>c
查看答案和解析>>
科目: 来源:2015届安徽省高二上学期期中考试化学试卷(解析版) 题型:选择题
在相同温度下,将H2和N2两种气体按不同比例通入相同的恒容密闭容器中,发生反应:3H2+N2 2NH3。
2NH3。 表示起始时H2和N2的物质的量之比,且起始时H2和N2的物质的量之和相等。下列图像正确的是( )
表示起始时H2和N2的物质的量之比,且起始时H2和N2的物质的量之和相等。下列图像正确的是( )

查看答案和解析>>
科目: 来源:2015届安徽省高二上学期期中考试化学试卷(解析版) 题型:选择题
将一定量的氨基甲酸铵固体置于容积恒定的真空容器中,发生反应:H2NCOONH4(s)  2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
|
温度 |
平衡浓度(mol·L-1) |
|
|
c(NH3) |
c(CO2) |
|
|
T1 |
0.1 |
|
|
T2 |
|
0.1 |
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,转化的H2NCOONH4的物质的量Δn(T2)=2Δn(T1)
查看答案和解析>>
科目: 来源:2015届安徽省高二上学期期中考试化学试卷(解析版) 题型:选择题
在t℃时,向一密闭容器(固定体积)中放入1mol A和1mol B,发生反应A(s) + B(g)  C(g)
+ 2D(g)达平衡时C的含量为m%,保持温度不变,若按下列配比的物质放入该容器中,达平衡时C的含量仍为m%的是( )
C(g)
+ 2D(g)达平衡时C的含量为m%,保持温度不变,若按下列配比的物质放入该容器中,达平衡时C的含量仍为m%的是( )
A.2molA和1molB B.2molD,1molA和1molB
C.2molC和4molD D.1molC和1molD
查看答案和解析>>
科目: 来源:2015届安徽省高二上学期期中考试化学试卷(解析版) 题型:选择题
可逆反应①X(g)+2Y(g)
 2Z(g)、②2M(g)
2Z(g)、②2M(g)  N(g)+P(g)分别在密闭容器的两个反应室中进行, 反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行, 反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示: 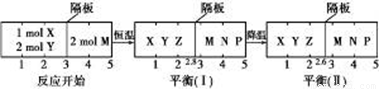
下列判断正确的是( )
A.在平衡(Ⅰ)和平衡(Ⅱ)中, M的体积分数相等
B.达平衡(Ⅰ)时, X的转化率为
C.达平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为14∶15
D.反应①的正反应是吸热反应
查看答案和解析>>
科目: 来源:2015届安徽省高二上学期期中考试化学试卷(解析版) 题型:选择题
在相同温度下,体积均为1 L的四个密闭容器中,保持温度和容积不变,以四种不同的投料方式进行反应。平衡时有关数据如下(已知2SO2(g)+O2(g) 2SO3(g)ΔH=-196.6 kJ·mol-1)。
2SO3(g)ΔH=-196.6 kJ·mol-1)。
|
容器 |
甲 |
乙 |
丙 |
丁 |
|
起始投料量 |
2 mol SO2+1 mol O2 |
1 mol SO2+0.5 mol O2 |
2 mol SO3 |
2 mol SO2+2 mol O2 |
|
反应放出或吸收的热量(kJ) |
a |
b |
c |
d |
|
平衡时c(SO3) (mol·L-1) |
e |
f |
g |
h |
下列关系正确的是( )
A.a=c;e=g B.a>2b;e>2f C.a>d;e>h D.c+98.3e>196.6
查看答案和解析>>
科目: 来源:2015届安徽省高二上学期期中考试化学试卷(解析版) 题型:填空题
废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
A.热裂解形成燃油B.露天焚烧 C.作为有机复合建筑材料的原料D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H=64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) △H=-196.46kJ·mol-1
H2(g)+1/2O2(g)=H2O(l)
△H=-285.84kJ·mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。
(3)控制其他条件相同,印刷电路板的金属粉末用10℅H2O2和3.0mol·L-1H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
铜平均溶解速率(×10-3 mol·L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是 。
(5) 已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ;△H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g);△H2
SiO2(s)+CaO(s)=CaSiO3(s) ;△H3
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) ; H
H
用△H1、△H2和△H3表示 H,
H, H=
。
H=
。
(6)已知1 g FeS2(s)完全燃烧生成放出7.1 kJ热量,FeS2燃烧反应的热化学方程式为 。
查看答案和解析>>
科目: 来源:2015届安徽省高二上学期期中考试化学试卷(解析版) 题型:填空题
用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件, 能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅, 其反应如下: 3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g) ΔH <0
Si3N4(s)+12HCl(g) ΔH <0
完成下列填空:
(1)在一定温度下进行上述反应, 若反应容器的容积为2 L, 3 min后达到平衡, 测得固体质量增加了2. 80 g, 则转移电子的物质的量为 ,H2的平均反应速率为 mol/(L·min); 该反应的平衡常数表达式K= 。
(2)上述反应达到平衡后, 下列说法正确的是 。
a. 其他条件不变, 压强增大, 平衡常数K减小
b. 其他条件不变, 温度升高, 平衡常数K减小
c. 其他条件不变, 增大Si3N4物质的量,平衡向左移动
d. 其他条件不变, 增大HCl物质的量,平衡向左移动
(3)一定条件下, 在密闭恒容的容器中, 能表示上述反应达到化学平衡状态的是 。
A. 3v逆(N2)=v正(H2) B. v正(HCl)=4v正(SiCl4)
C. 混合气体密度保持不变 D. c(N2)∶c(H2)∶c(HCl)=1∶3∶6
(4)若平衡时H2和HCl的物质的量之比为 ,
保持其他条件不变, 降低温度后达到新的平衡时,
H2和HCl的物质的量之比
,
保持其他条件不变, 降低温度后达到新的平衡时,
H2和HCl的物质的量之比  (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
查看答案和解析>>
科目: 来源:2015届安徽省高二上学期期中考试化学试卷(解析版) 题型:填空题
在某温度下,体积恒定的密闭容器中加入2 molN2和4 molH2,发生如下反应:
N2(g)+3H2(g) 2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求:
2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求:
(1)达到平衡时,N2的转化率为_______________, NH3的体积分数为 。
(2)若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均为正数,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。a、b、c取值必须满足的一般条件是 , 。
(3)科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池总反应式为:4NH3+3O2=2N2+6H2O,电解质溶液应显 (填“酸性” 、“中性” 或“碱性” ),写出正极的电极反应方程式 。
查看答案和解析>>
科目: 来源:2015届安徽省高二上学期期中考试化学试卷(解析版) 题型:填空题
一定温度下2L的恒容容器甲中,加入2moL碳和2moLCO2发生如下反应:
C(s)+CO2(g)  2CO(g) △H>0
2CO(g) △H>0
测得容器中CO2的物质的量随时间t的变化关系如图所示。
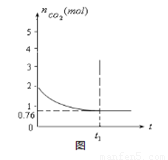
(1)该反应的ΔS 0(填“>”、“<”或“=”)。在 (填“较高”或“较低”) 温度下有利于该反应自发进行。
(2)列式并计算上述温度下此反应的平衡常数K 。(结果保留一位小数)
(3)向上述平衡体系中再通入CO2,则CO2的转化率 (填增大、减小、不变、无法确定)。
(4)相同温度下,2L的恒容容器丙中加入4moL碳、4moLCO2和4moLCO。开始反应时v(正) v(逆)(填>、 <、﹦)。
(5)相同温度下,2L的恒容容器乙中加入4moL碳和4moLCO2,达到平衡。请在图中画出乙容器中CO2的物质的量随时间t变化关系的预期结果示意图。(注明平衡时CO2的物质的量)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com