
科目: 来源:2013-2014学年陕西省高三12月月考化学试卷(解析版) 题型:选择题
已知CuSO4溶液分别与Na2CO3、Na2S溶液的反应情况如下:
|
CuSO4 +Na2CO3 |
主要: Cu2+ + CO32- + H2O = Cu(OH)2↓ + CO2↑ |
|
次要: Cu2+ + CO32-= CuCO3↓(几乎不发生反应) |
|
|
CuSO4 +Na2S |
主要: Cu2+ + S2- = CuS↓ |
|
次要: Cu2+ + S2- + 2H2O = Cu(OH)2↓ + H2S↑(几乎不发生反应) |
据此判断,下列几种物质Ksp大小的比较中正确的是
A.CuS <Cu(OH)2<CuCO3 B.Cu(OH)2<CuS< CuCO3
C.CuCO3<Cu(OH)2<CuS D.CuCO3< CuS < Cu(OH)2
查看答案和解析>>
科目: 来源:2013-2014学年陕西省高三12月月考化学试卷(解析版) 题型:选择题
除去下列物质中的少量杂质(括号内为杂质),所选试剂和分离方法合理的是
A.苯(苯酚):溴水、过滤
B.CO2气体(HCl):饱和Na2CO3溶液、洗气
C.淀粉(氯化钠):蒸馏水、渗析
D.水(Br2):乙醇、分液
查看答案和解析>>
科目: 来源:2013-2014学年陕西省高三12月月考化学试卷(解析版) 题型:选择题
1 L某混合溶液中,溶质X、Y的浓度都为0.1 mol/L,向混合溶液中滴加某溶液Z(0.1 mol/L氢氧化钠或硫酸溶液)至溶液呈中性,所得沉淀的物质的量如图所示,则X、Y、Z分别是
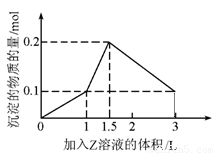
A.偏铝酸钠、氢氧化钡、硫酸
B.偏铝酸钠、氯化钡、硫酸
C.氯化铝、氯化铁、氢氧化钠
D.氯化铝、氯化镁、氢氧化钠
查看答案和解析>>
科目: 来源:2013-2014学年陕西省高三12月月考化学试卷(解析版) 题型:选择题
900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应:
 ΔH=a kJ·mol—1。
ΔH=a kJ·mol—1。
经一段时间后达到平衡。反应过程中测定的部分数据见下表:
|
时间/min |
0 |
10 |
20 |
30 |
40 |
|
n(乙苯)/mol |
0.40 |
0.30 |
0.24 |
n2 |
n3 |
|
n(苯乙烯)/mol |
0.00 |
0.10 |
n1 |
0.20 |
0.20 |
下列说法正确的是
A.反应在前20 min的平均速率为v(H2)=0.008mol·L-1·min-1
B.保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08 mol·L-1,则a<0
C.保持其他条件不变,再向容器中充入0.40 mol乙苯和0.40molH2,平衡不移动
D.达平衡状态的标志是气体密度不再变化
查看答案和解析>>
科目: 来源:2013-2014学年陕西省高三12月月考化学试卷(解析版) 题型:选择题
固体NH5属于离子晶体。它与水反应的化学方程式为NH5+H2O→NH3·H2O+H2↑,它也能跟乙醇发生类似的反应,并都产生氢气。下列有关NH5叙述正确的是
A.含有NH4+和H-
B.NH5中N元素的化合价为+5价
C.1 mol NH5中含有5NA个N—H键
D.与乙醇反应时,NH5被还原
查看答案和解析>>
科目: 来源:2013-2014学年陕西省高三12月月考化学试卷(解析版) 题型:选择题
下图是元素周期表的一部分,下列说法中正确的是

A.元素①位于第二周期第ⅣA族
B.气态氢化物的稳定性:④>②
C.最高价氧化物对应水化物酸性:⑤>④
D.元素的最高正化合价:③=⑤
查看答案和解析>>
科目: 来源:2013-2014学年陕西省高三12月月考化学试卷(解析版) 题型:填空题
A、B、C、D、E五种物质均含有同一种元素,它们之间有如下转化关系:
(1)若A为单质,B、C均属于盐类,B的水溶液呈酸性,C的水溶液呈碱性,D是一种白色沉淀。写出下列过程的离子方程式:
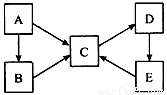
①B的水溶液呈酸性____________。 ②C→D_______________。 ③E→C________________。
(2)若A~E均为化合物。A是淡黄色固体;B、C两溶液在等物质的量浓度时,C 溶液的pH较小。电解D的水溶液是最重要的工业生产之一,D→E→C也是工业制备C的普遍方法。
①A的电子式为__________。
②电解D的水溶液时,反应的离子方程式为________________。
③生铁浸入D溶液而发生锈蚀,正极的电极反应为________________。
(3)若A为单质,C、D的相对分子质量相差16,0.1mol/L E溶液中只有3种离子,且常温下溶液中的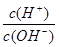 =1012。
=1012。
①B→C的化学方程式为: 。
②A→C的反应中,每转移1 mol e-就会吸热45 kJ,写出该反应的热化学方程式: 。
查看答案和解析>>
科目: 来源:2013-2014学年陕西省高三12月月考化学试卷(解析版) 题型:填空题
雾霾已经严重影响我们的生存环境。火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。


图22-1 图22-2 图22-3
(1)利用甲烷催化还原NOx:
①CH4(g) + 4NO2(g) = 4NO(g) + CO2(g) + 2H2O(g) △H1=-574kJ•mol-1
②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H2=-1160kJ•mol-1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)将CO2转化为甲醇的热化学方程式为:
CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线(见图22-1),则上述CO2转化为甲醇反应的△H3 0(填“>”、“<”或“=”)。
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图22-2所示。
下列说法正确的是 (填字母代号)。
A.第10min后,向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时c(CH3OH) =1.5 mol/L
B.达到平衡时,氢气的转化率为0.75
C.0~10分钟内,氢气的平均反应速率为0.075mol/(L•min)
D.该温度下,反应的平衡常数的值为3/16
E.升高温度将使n(CH3OH)/n(CO2)增大
(3)某种脱硫工艺中将烟气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1∶1,则该反应的化学方程为 。
(4)电化学降解NO3- 的原理如题22-3图所示。
①电源正极为 (填“A”或“B”),阴极反应式为 。
②若电解过程中转移了1mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为 g。
查看答案和解析>>
科目: 来源:2013-2014学年陕西省高三12月月考化学试卷(解析版) 题型:实验题
亚硝酸钠(NaNO2)暴露于空气中会与氧气反应生成硝酸钠,在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
已知:①NO+NO2+2OH—==2NO2—+H2O ②气体液化的温度:NO2:21℃,NO:-152℃

(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):A、C、 、 、 。
(2)反应前应打开弹簧夹,先通人一段时间氮气,排除装置中的空气,目的是 。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴人70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是 。
②装置E的作用是 。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为 。如果没有装置C,对实验结论造成的影响是 。
(5)通过上述实骏探究过程,可得出装置A中反应的化学方程式是 。
查看答案和解析>>
科目: 来源:2013-2014学年陕西省高三12月月考化学试卷(解析版) 题型:填空题
硫酸工厂尾气处理时用NaOH溶液吸收SO2生成NaHSO3,再用NaIO3按下列反应(配平)来制取单质I2。NaIO3来源于自然界的矿物。
① NaIO3 + NaHSO3— NaI + Na2SO4 + H2SO4 ② IO3-+I-+H+—I2+H2O
(1)配平上述反应
(2)在含5molNaHSO3的溶液中逐滴加入NaIO3溶液。请计算开始产生单质I2及产生单质I2最大值时所滴入的NaIO3的物质的量各是多少?
(3)25℃时,H2SO3  HSO3-
+ H+的电离常数Ka= 1×10-2 mol/L,则该温度下NaHSO3的水解平衡常数Kh=
mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-
+ H+的电离常数Ka= 1×10-2 mol/L,则该温度下NaHSO3的水解平衡常数Kh=
mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中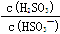 将 (填“增大”“减小”或“不变”,下同); 加入少量NaOH溶液,
将 (填“增大”“减小”或“不变”,下同); 加入少量NaOH溶液,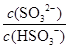 的值
;加入少量水,水的电离程度将 。
的值
;加入少量水,水的电离程度将 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com