
科目: 来源:2013-2014学年重庆市五区高三第一次学生学业调研抽测理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.原子最外层电子数为2的元素一定处于周期表的第IIA族
B.构成单质的分子中一定含有共价键
C.同主族元素形成的氧化物的晶体类型均相同
D.金属与非金属元素形成的化合物可能是离子化合物
查看答案和解析>>
科目: 来源:2013-2014学年重庆市五区高三第一次学生学业调研抽测理综化学试卷(解析版) 题型:选择题
下列说法中,正确的是
A.25℃时,1L pH=3的盐酸和醋酸能消耗等质量的镁粉
B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)将增大
C.V1L pH=12的NaOH溶液与V2L pH=2的HA溶液混合,若混合液显中性,则V1≤V2
D.在0.1mol·L-1 NaHCO3溶液中,加入少量NaOH固体,Na+和CO32―离子浓度均增大
查看答案和解析>>
科目: 来源:2013-2014学年重庆市五区高三第一次学生学业调研抽测理综化学试卷(解析版) 题型:选择题
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是

A.加热时,①上部汇聚了固体碘,说明碘的热稳定性较差
B.加热时,②、③中的溶液均变红,冷却后又都变为无色
C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅
D.四个“封管实验”中都有可逆反应发生
查看答案和解析>>
科目: 来源:2013-2014学年重庆市五区高三第一次学生学业调研抽测理综化学试卷(解析版) 题型:选择题
一定条件下,向密闭容器中加入X物质发生反应:3X(g) 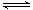 Y(g)
+ Z(g) △H<0,反应一段时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示。下列说法中不正确的是
Y(g)
+ Z(g) △H<0,反应一段时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示。下列说法中不正确的是
|
反应时间(min) |
0 |
5 |
15 |
17 |
20 |
|
X的浓度(mol·L-1) |
1.0 |
0.4 |
0.4 |
0.7 |
0.7 |
A.0~5 min时,该反应的速率为v(X)=0.12 mol·L-1·min-1
B.5 min时反应达到平衡,该温度下的平衡常数值为0.625
C.15 min时改变的条件可能是降低温度
D.从初始到18 min时,X的转化率为30 %
查看答案和解析>>
科目: 来源:2013-2014学年重庆市五区高三第一次学生学业调研抽测理综化学试卷(解析版) 题型:填空题
X、Y、Z、W、P为短周期的主族元素,其原子序数依次增大。Y、Z、W、P位于同一周期。X元素形成的单质是自然界中含量最多的气体,1mol Y的单质分别与足量盐酸和氢氧化钠溶液反应生成的气体在标况下均为33.6L。W的原子最外层电子数与核外电子总数之比为3∶8,X的原子序数是Z的原子序数的一半。
(1)Z的原子结构示意图为 ,W与P可形成原子个数比为1∶2的化合物,其电子式为 。
(2)经测定,在2.5×1.01×105 Pa下,Y 与P形成的化合物的熔点为190℃,沸点为180℃,则该化合物为 晶体。
(3)Z、W、P三种元素的气态氢化物稳定性由高到低的顺序是 (填化学式)。
(4)Y与W形成的化合物遇水分解,发生反应的化学方程式为 。
(5)X的三氟化物是微电子工业中优良的等离子刻蚀气体,但在潮湿的环境中能与水发生反应生成无色气体,遇空气变为红棕色。该反应的化学方程式为 ,若0.6mol X的三氟化物完全反应,则转移的电子总数约为 。
查看答案和解析>>
科目: 来源:2013-2014学年重庆市五区高三第一次学生学业调研抽测理综化学试卷(解析版) 题型:实验题
工业尾气中氮氧化物通常采用氨催化吸收法,其原理是NH3与NOx在催化剂作用下反应生成无毒的物质。某校活动小组同学采用以下装置和步骤模拟工业上氮氧化物的处理过程。

I.探究制取NH3的方法
(1)在上述装置中,H能快速、简便制取NH3,装置中需要添加的反应试剂为 。
(2)为探究更好的实验效果,活动小组同学采用上述C装置来制取氨气,在控制实验条件相同的情况下,获得下表中实验数据。
|
试剂组合序号 |
固体试剂 |
NH3体积(mL) |
|
|
a |
6.0 g Ca(OH)2(过量) |
5.4 g NH4Cl |
1344 |
|
b |
5.4g (NH4)2SO4 |
1364 |
|
|
c |
6.0 g NaOH(过量) |
5.4 g NH4Cl |
1568 |
|
d |
5.4g (NH4)2SO4 |
1559 |
|
|
e |
6.0 g CaO(过量) |
5.4 g NH4Cl |
1753 |
|
f |
5.4 g (NH4)2SO4 |
1792 |
分析表中数据,你认为哪种方案制取氨气的效果最好 (填序号),从该方案选择的原料分析制气效果好的可能原因是 。
II.模拟尾气处理
活动小组同学选用上述部分装置,按下列顺序连接成模拟尾气处理装置进行实验。
(1)请从上述装置中选择你认为合理的进行补充(所选装置不能重复)。

(2)A中反应的离子方程式为 。
(3)D装置的作用有:使气体混合均匀、调节气流速度、 。
(4)D装置中的液体还可换成 (填序号)。
a.H2O b.CCl4 c.浓H2SO4 d.CuSO4溶液
(5)该小组同学所设计的模拟尾气处理装置中还存在一处明显的缺陷是 。
查看答案和解析>>
科目: 来源:2013-2014学年重庆市五区高三第一次学生学业调研抽测理综化学试卷(解析版) 题型:填空题
水是生命之源,与人类的生活密切相关。在化学实验和科学研究中,水有多种用途。
(1)下列说法中正确的是 (填序号)。
A.每一个水分子内含有两个氢键
B.水分子间存在范德华力,所以水分子稳定
C.分子间形成的氢键使水的熔点和沸点升高
D.冰熔化时水分子内共价键发生断裂
(2)科学家将水置于一个足够强的电场中,在20℃时水分子瞬间凝固形成“暖冰”,则“暖冰”中水分子的空间构型为 。
(3)水分子在特定条件下易形成水合氢离子(H3O+)。其中含有的化学键为 。
(4)如果需要增大水的电离程度,除了升高温度外,还可以采用的方法有 (回答一种即可)。若室温时,将某一元酸HA加水配成0.1 mol·L-1的稀溶液,此时HA在水中有0.1%发生电离,则由HA电离出的c(H+)约为水电离出的c(H+)的 倍。
(5)将一定量的Na2SO3固体溶于水,所得溶液中的电荷守恒关系式为 。
(6)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差异进行发电。已知该电池用金属银做负极,正极反应为5MnO2 +2Na++2e- Na2Mn5O10,请写出电池总反应式
。
Na2Mn5O10,请写出电池总反应式
。
查看答案和解析>>
科目: 来源:2013-2014学年重庆市五区高三第一次学生学业调研抽测理综化学试卷(解析版) 题型:填空题
铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为 。
(2)已知:Fe(s)+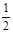 O2(g)
O2(g) FeO(s)
△H=-272 kJ·mol-1
FeO(s)
△H=-272 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1
则高炉炼铁过程中
FeO(s)+CO(g) Fe(s)+CO2(g) △H=
。
Fe(s)+CO2(g) △H=
。
(3)铁红(Fe2O3)是一种红色颜料。将一定量的铁红溶于160mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为 。
(4)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。
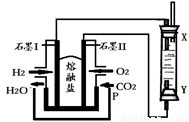
①石墨I电极上的电极反应式为 。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
A.X、Y两端都必须用铁作电极
B.可以用NaOH溶液作为电解液
C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH-
D.白色沉淀只能在阳极上产生
③若将所得Fe(OH)2沉淀暴露在空气中,其颜色变化为 ,该反应的化学方程式为 。
查看答案和解析>>
科目: 来源:2013-2014学年重庆市高三上学期12月月考理综化学试卷(解析版) 题型:选择题
化学学习中,推理是一种重要的学习方法,下列推论正确的是( )
A.由“BF3和SO3互为等电子体”,可推知二者均为非极性分子
B.由“某过程发生化学键断裂”,可推知该过程发生了化学变化
C.由“蒸干NaCl溶液得NaCl固体”,可推知蒸干MgCl2溶液得MgCl2固体
D.由“同温度下等浓度的Na2CO3溶液比Na2SO3溶液的pH大”,可推知C比S的非金属性弱
查看答案和解析>>
科目: 来源:2013-2014学年重庆市高三上学期12月月考理综化学试卷(解析版) 题型:选择题
常温下,下列各组比值为1:2的是( )
A.0.1 mol/L与0.2 mol/L醋酸溶液,c (H+)之比
B.0.1 mol/L NaHCO3溶液,c(HCO3﹣)与c(Na+)之比
C.pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比
D.pH=3的硫酸与醋酸溶液,c(SO42﹣)与c(CH3COO﹣)之比
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com