
科目: 来源:2013-2014学年贵州省六校联盟高三第一次联考化学试卷(解析版) 题型:填空题
X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大。有关信息如下表:
|
X |
动植物生长不可缺少的元素,是蛋白质的重要成分 |
|
Y |
地壳中含量居第一位 |
|
Z |
短周期中其原子半径最大 |
|
Q |
生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
|
M |
海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
(1)X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,请写出该气态氢化物的电子式____________。
(2)已知37Rb和53I都位于第五周期,分别与Z和M同一主族。下列有关说法正确的是____________(填序号)。
A.原子半径:Rb>I
B.RbM中含有共价键
C.气态氢化物热稳定性:M>I
D.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
(3)X、Y组成的一种无色气体遇空气变为红棕色。将标准状况下40 L该无色气体与15 L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐。请写出该反应的离子方程式 。
查看答案和解析>>
科目: 来源:2013-2014学年贵州省六校联盟高三第一次联考化学试卷(解析版) 题型:填空题
非金属单质A,经如下图所示的过程转化为含氧酸D,已知D为常见强酸

请回答下列问题:
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体
①D的化学式是
②在工业生产中B气体的大量排放被雨水吸收后形成了 而污染了环境
(2)若A在常温下为气体,C是红棕色气体。①A和C的化学式分别是:A ;C
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式
查看答案和解析>>
科目: 来源:2013-2014学年贵州省六校联盟高三第一次联考化学试卷(解析版) 题型:填空题
(1)二氧化硫的催化氧化的过程如图所示,其中a、c二步的化学方程式可表示为:
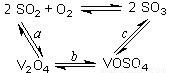
SO2+V2O5 SO3+ V2O4
SO3+ V2O4
4VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。
该反应的催化剂是 (写化学式)
(2) 550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 M Pa。试计算反应2SO3 2SO2+O2
在550 ℃时的平衡常数K= 。
2SO2+O2
在550 ℃时的平衡常数K= 。
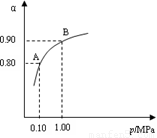
(3)550 ℃时,将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应 达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是
A.升高温度
B.充入He(g),使体系总压强增大
C.再充入2 mol SO2和1 mol O2
D.再充入1 mol SO2和1 mol O2
(4)维持温度不变条件下使之发生如下反应:2SO2+O2 2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。
2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。
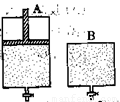
试填写下列空格:
A容器达到平衡时所需的时间比B容器__________(填:“短或长”);平衡时A容器中SO2的转化率比B容器_______(填:“大或小”);达到所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容器的混合气体中SO3的体积分数_________(填“增大”、“减小”或“不变”,下同);B容器的混合气体中SO3的体积分数_________。
查看答案和解析>>
科目: 来源:2013-2014学年贵州省六校联盟高三第一次联考化学试卷(解析版) 题型:实验题
PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
|
|
熔点/℃ |
沸点/℃ |
密度/g·mL-1 |
其他 |
|
黄磷 |
44.1 |
280.5 |
1.82 |
2P(过量)+3Cl2 |
|
PCl3 |
—112 |
75.5 |
1.574 |
遇水生成H3PO3和HCl,遇O2生成POCl3 |
|
POCl3 |
2 |
105.3 |
1.675 |
遇水生成H3PO4和HCl,能溶于PCl3 |
(一)制备:RU 图是实验室制备PCl3的装置(部分仪器已省略)
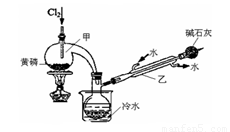
(1)仪器乙的名称____________。
(2)实验室用漂白粉加浓盐酸制备Cl2的化学方程式:_______________________ 。
(3)碱石灰的作用是____________________。
(4)向仪器甲中通入干燥Cl2之前,应先通入一 段时间的CO2,其目的是____________________。
(二)提纯:
(5)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过_________________(填实验操作名称),即可得到PCl3的纯品。
(三)分析:
测定产品中PCl3纯度的方法如下:迅速称取4.200 g产品,水解完全后配成500mL溶液,取出25.00mL加入过量的0.1000 mol/L 20.00 mL 碘溶液,充分反应后再用0.1000 mol/L Na2S2O3溶液滴定过量的碘,终点时消耗10.00 mL Na2S2O3溶液。
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;假设测定过程中没有其他反应。
(6)根据上述数据,该产品中PCl3的质量分数为____________________ 。若滴定终点时俯视读数,则PCl3的质量分数_______(偏大、偏小、或无影响)
查看答案和解析>>
科目: 来源:2013-2014学年贵州省六校联盟高三第一次联考化学试卷(解析版) 题型:填空题
下面是C60、金刚石和二氧化碳的分子模型。

请回答下列问题:
(1)硅与碳同主族,写出硅原子基态时的核外电子排布式:_________________
(2)从晶体类型来看,C60属于_________晶体。
(3)二氧化硅结构跟金刚石结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察图乙中金刚石的结构,分析二氧化硅的空间网状结构中,Si、O原子形成的最小环上O原子的数目是__________________________;晶体硅中硅原子与共价键的个数比为
(4)图丙是二氧化碳的晶胞模型,图中显示出的二氧化碳分子数为14个。实际上一个二氧化碳晶胞中含有________个二氧化碳分子,二氧化碳分子中 键与
键与 键的个数比为
。
键的个数比为
。
(5)有机化合物中碳原子的成键方式有多种,这也是有机化合物种类繁多的原因之一。丙烷分子中2号碳原子的杂化方式是_______,丙烯分子中2号碳原子的杂化方式是_______,丙烯分子中最多有 个原子共平面。
查看答案和解析>>
科目: 来源:2013-2014学年贵州省六校联盟高三第一次联考化学试卷(解析版) 题型:填空题
A是生产某新型工程塑料的基础原料之一,分子式为C10H10O2,其分子结构模型如图,所示(图中球与球之间连线代表化学键单键或双键)。

(1)根据分子结构模型写出A的结构简式 ___________ ;
(2)拟从芳香烃 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下:
已知:A在酸性条件下水解生成有机物B和甲醇。

(a)写出⑤反应类型__________ ;写出H的结构简式 ___________
(b)已知F分子中含有“—CH2OH”,通过F不能有效、顺利地获得B,其原因是 _______
(c)写出反应方程式(注明必要的条件)
⑥ ________________________________________________________
⑦ __________________________________________________________
(3)A的同分异构体有多种,同时满足下列条件A的同分异构体有 种:
ⅰ.含有苯环,苯环上有两个侧链且苯环上一氯取代物有两种;
ⅱ.与A有相同的官能团。
查看答案和解析>>
科目: 来源:2013-2014学年贵州省六盘水市六校上学期期末联合统考理综化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数的数值,下列说法中正确的是 ( )
A.在密闭容器中加入1.5 mol H2和0.5 mol N2,充分反应可得到NH3分子数为NA
B.一定条件下,2.3 g的Na完全与O2反应生成3.6 g产物时失去的电子数为0.1 NA
C.1.0 L的0.1 mol·L-1 Na2S溶液中含有的S2-离子数为0.1 NA
D.标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA
查看答案和解析>>
科目: 来源:2013-2014学年贵州省六盘水市六校上学期期末联合统考理综化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是 ( )
A.无色透明的溶液:Na+、Al3+、Cl-、OH-
B.pH=1的溶液:Na+、NH4+ 、Cu2+ 、NO3-
C.与铝反应产生大量氢气的溶液:Na+、K+、Cl-、Al3+
D.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
查看答案和解析>>
科目: 来源:2013-2014学年贵州省六盘水市六校上学期期末联合统考理综化学试卷(解析版) 题型:选择题
在蒸发皿中加热蒸干并灼烧下列物质的溶液,可以得到该物质固体的是 ( )
①AlCl3;②NaHCO3 ;③NaAlO2;④MgSO4 ;⑤Na2SO3 ;⑥KMnO4;⑦Fe2(SO4)3;⑧FeCl2
A.①②⑤ B. ⑥⑦⑧ C. ③④⑦ D.④⑤⑥
查看答案和解析>>
科目: 来源:2013-2014学年贵州省六盘水市六校上学期期末联合统考理综化学试卷(解析版) 题型:选择题
下列叙述中正确的是 ( )
A.液溴易挥发,在存放液溴的试剂瓶中应加水封
B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com