
科目: 来源: 题型:填空题

| 棉球 | 棉球上滴加试剂 | 实验现象 | 解释或结论 |
| a | ________ | 棉球变白,微热后又恢复红色 | 解释:________ 结论:该气体具有漂白性 |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式:________ |
| C | ________ | 棉球变为白色 | 化学方程式: 结论:该气体具有________性 |
查看答案和解析>>
科目: 来源: 题型:单选题
 H2↑+Cl2↑
H2↑+Cl2↑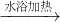 CH3COO-+NH4++3NH3+2Ag↓+H2O
CH3COO-+NH4++3NH3+2Ag↓+H2O查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 阳离子 | Ag+ Na+ Fe3+ Al3+ Ba2+ |
| 阴离子 | OH- Cl- 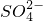 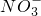 |
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题

| 实验步骤 | 实验现象 | 实验结论(步骤2用离子方程式表示) |
| 1.取食盐少许于一支试管中,加入适量的蒸馏水,振荡. | 固体完全溶解 | 食盐及碘酸钾都能溶于水 |
| 2.向上述溶液中滴加适量的亚硫酸氢钠溶液,振荡. | 溶液出现棕黄色 | ______ |
| 3.再向上述溶液中滴加淀粉溶液,振荡. | 溶液变成蓝色 | ______ |
 KIO3+3H2↑,则阳极的电极反应式为______;阴极附近pH值______(填“增大”、“减小”、“不变”).
KIO3+3H2↑,则阳极的电极反应式为______;阴极附近pH值______(填“增大”、“减小”、“不变”).查看答案和解析>>
科目: 来源: 题型:解答题
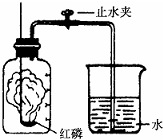 某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下:
某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下: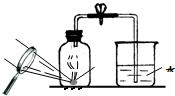
查看答案和解析>>
科目: 来源: 题型:单选题
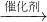 N2+CO2下列关于此反应的说法中,不正确的是
N2+CO2下列关于此反应的说法中,不正确的是查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com