
科目: 来源:2013-2014学年湖南省、汝城县第一中学高三11月联考化学试卷(解析版) 题型:选择题
用惰性电极电解50 mL锰酸钾溶液:K2MnO4+H2O→KMnO4+H2↑+KOH(未配平),当生成112 mL氢气(标准状况)时停止通电。下列判断正确的是 ( )
A.K+浓度减小 B.KMnO4在阳极区生成
C.阴极周围溶液的pH减小 D.反应过程中共转移0.005mol电子
查看答案和解析>>
科目: 来源:2013-2014学年湖南省、汝城县第一中学高三11月联考化学试卷(解析版) 题型:选择题
全钒液流电池是一种新型的绿色环保储能电池,该电池性能优良,其电池总反应为:V3++VO2++H2O VO2++2H++V2+。下列叙述正确的是
( )
VO2++2H++V2+。下列叙述正确的是
( )
A.充电时阳极附近溶液的酸性减弱
B.充电时阳极反应式为:VO2++2H++e-=VO2++H2O
C.放电过程中电解质溶液中阳离子移向负极
D.放电时每转移1mol电子,负极有1mol V2+被氧化
查看答案和解析>>
科目: 来源:2013-2014学年湖南省、汝城县第一中学高三11月联考化学试卷(解析版) 题型:选择题
有关能量的判断或表示方法正确的是 ( )
A.由:H+(aq) + OH-(aq) = H2O(l) △H =-57.3kJ/mol,可知:含1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量等于57.3 kJ
B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多
C.从C(石墨)= C(金刚石) △H = + 1.9kJ/mol,可知石墨比金刚石更稳定
D.2gH2完全燃烧生成液态水放出285.8kJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2 H2O(l) △H =-285.8kJ/mol
查看答案和解析>>
科目: 来源:2013-2014学年湖南省、汝城县第一中学高三11月联考化学试卷(解析版) 题型:选择题
在指定条件下,下列各组离子一定能大量共存的是( )
A.滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3-
B.滴入KSCN显血红色的溶液中:NH4+、Mg2+、SO42-、Cl-
C.c(OH-)/ c(H+)=1012的溶液中:NH4+、Al3+、NO3-、CO32-
D.由水电离的c(H+)=1.0×10-13 mol·L-1的溶液中:K+、NH4+、AlO2-、HCO3-
查看答案和解析>>
科目: 来源:2013-2014学年湖南省、汝城县第一中学高三11月联考化学试卷(解析版) 题型:选择题
下列叙述不正确的是( )
A.电解法精炼铜时粗铜连接电源的正极
B.船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.铜锌原电池中铜电极上发生氧化反应
D.工业上电解饱和食盐水的阳极反应:2Cl- —2e -=Cl2↑
查看答案和解析>>
科目: 来源:2013-2014学年湖南省、汝城县第一中学高三11月联考化学试卷(解析版) 题型:填空题
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。回答下列问题:
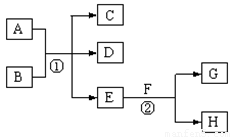
(1)在反应②中,每生成 2.24L 气体G(标准状况)时,该反应转移电子的物质的量是 mol。
(2)若反应①在加热条件下进行,单质A和化合物B按物质的量之比为1:2发生反应,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,则反应①的化学方程式是 。
(3)若反应①在溶液中进行,A是一元强碱,B是一种酸式盐,D是一 种使湿润红色石蕊试纸变蓝的气体,且B遇盐酸能生成使品红溶液褪色的气体。在加热条件下,当A过量时,反应①的离子方程式是 。
( 4)由金红石(TiO2)制取单质Ti,涉及到的步骤为:TiO2→TiCl4 Ti
Ti
①C(s) + O2(g) = CO2(g); △H = -393.5 kJ•mol-1
②2CO(g) + O2(g) = 2CO2(g); △H = -566 kJ•mol-1
③TiO2(s) + 2Cl2(g) = TiCl4(s) + O2(g); △H = +141 kJ•mol-1
则TiO2(s) + 2Cl2(g) + 2C(s)= TiCl4(s) + 2CO(g) 的△H = _________________。
查看答案和解析>>
科目: 来源:2013-2014学年湖南省、汝城县第一中学高三11月联考化学试卷(解析版) 题型:填空题
已知A、B、C、D、E五种主族元素分属三个短周期,且原子序数依次增大。A、C同主族,可形成离子化合物CA;B、D同主族,可形成DB2、DB3两种分子。请回答下列问题:
(1)元素E在元素周期表中的位置是
(2)A、B两种元素能形成两种常温下呈液态的化合物M、N,具有强氧化性的化合物M的电子式可表示为 ;化合物N在同主族元素形成有具有相同结构的物质中,具有较高的沸点,其原因是 。
(3)A、B、C、D中的三种或四种元素能形成多种离子化合物,其水溶液呈碱性的有 (写出所有化合物,用化学式表示,下同),呈酸性的有 (写出所有化合物)。
(4)元素B、E的单质或两元素之间形成的化合物可作水消毒剂的有 (写出其中两种物质的化学式)。
查看答案和解析>>
科目: 来源:2013-2014学年湖南省、汝城县第一中学高三11月联考化学试卷(解析版) 题型:填空题
某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为 。
(2)称取两种固体各2 g,分别加入两个小烧杯中,再各加10 mL 蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论 。
②同学们在两烧杯中还观察到以下现象。其中,盛放Na2CO3的烧杯中出现的现象是
(填字母序号)。
a.溶液温度下降 b.溶液温度升高
c.滴入酚酞后呈无色 d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置I和II中分别放入药品,将气球内的固体同时倒入试管中。
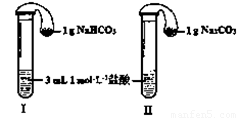
①两试管中均产生气体, (填“I”或“II”)的反应程度更为剧烈。
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是 。
a.装置I的气球体积较大 b.装置II的气球体积较大
c.生成气体的体积根据盐酸计算 d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象做出预测:
|
实验方案 |
预测现象 |
预测依据 |
|
操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 |
有白色沉淀 |
Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应Ca2+ + CO32- = CaCO3↓。 |
|
操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 |
无白色沉淀 |
NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 |
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体。则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为 。
查看答案和解析>>
科目: 来源:2013-2014学年湖南省、汝城县第一中学高三11月联考化学试卷(解析版) 题型:填空题
某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。

请回答:
I.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是 (填字母序号)。
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应式为 。
(3)实验过程中,SO42- (填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有 。
II.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH (填“增大” 、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe - 6e- + 8OH- =FeO42- + 4H2O 和4OH- - 4e- = 2H2O + O2↑ , 若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少 g。
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn =Fe2O3 +ZnO +2K2ZnO2
该电池正极发生的反应的电极反应式为 。
(7)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:____________________________。
查看答案和解析>>
科目: 来源:2013-2014学年湖南省长沙市高三第三次月考化学试卷(解析版) 题型:选择题
化学在生产和日常生活中有着重要的应用。下列说法不正确的是( )
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量
D.电解MgCl2溶液,可制得金属镁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com