
科目: 来源:2013-2014学年河北石家庄市高考猜题化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,下列判断正确的是
A.标准状况下,2.24 L 16O2和3.6 g 18O2均含有0.2NA个氧原子
B.1.7 g H218O2中含有的电子数为0.9 NA
C.电解精炼铜时,若阴极得到NA个电子,则阳极质量减少32g
D.标准状况下,2.24 L甲烷、戊烷混合物所含分子数为0.1NA
查看答案和解析>>
科目: 来源:2013-2014学年河北石家庄市高考猜题化学试卷(解析版) 题型:选择题
下列有关有机物同分异构体说法中不正确的是
A.分子式为C4H8的同分异构体共有(不考虑立体异构)5种
B.立方烷(C8H8)的六氯取代物有3种
C.分子式为C5H10O2的同分异构体中属于酯的有8种
D. 的一溴取代物有4种
的一溴取代物有4种
查看答案和解析>>
科目: 来源:2013-2014学年河北石家庄市高考猜题化学试卷(解析版) 题型:选择题
下列涉及的有机物及有机反应类型错误的是
A.乙烯分子与苯分子中碳碳键不同,但二者都能发生加成反应
B.酯、蛋白质、纤维素都能发生水解反应
C.苯、乙醇和乙酸都能发生取代反应
D.1 mol乙醇与1 mol乙酸在一定条件下,发生酯化反应可生成1 mol乙酸乙酯
查看答案和解析>>
科目: 来源:2013-2014学年河北石家庄市高考猜题化学试卷(解析版) 题型:选择题
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)的传感器煤矿巷道中的甲烷达到一定浓度时可以显示。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的是

A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B.电极b是正极,O2-由电极a流向电极b
C.电极a的反应式为:CH4 + 4O2- - 8e- === CO2 + 2H2O
D.当固体电解质中有1 molO2- 通过时,电子转移4 mol
查看答案和解析>>
科目: 来源:2013-2014学年河北石家庄市高考猜题化学试卷(解析版) 题型:选择题
下列说法及对应的离子方程式均正确的是
A.铁溶于稀HNO3,溶液变黄色:3Fe + 8H+ + 2NO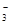 =
3Fe2+ + 2NO↑ + 4H2O
=
3Fe2+ + 2NO↑ + 4H2O
B.用惰性电极电解AlCl3溶液:Al3+ + 3Cl- + 3H2O  Al(OH)3↓
+ 3/2H2↑ + 3/2Cl2↑
Al(OH)3↓
+ 3/2H2↑ + 3/2Cl2↑
C.用酚酞作指示剂,在Na2CO3溶液中滴入乙酸溶液:CO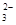 +
2CH3COOH = 2CH3COO- + H2O + CO2↑
+
2CH3COOH = 2CH3COO- + H2O + CO2↑
D.在K2Cr2O7溶液中滴入NaOH溶液,溶液变为橙色:Cr2O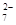 (橙)+ H2O
(橙)+ H2O 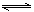 2CrO
2CrO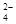 (黄)+2H+
(黄)+2H+
查看答案和解析>>
科目: 来源:2013-2014学年河北石家庄市高考猜题化学试卷(解析版) 题型:选择题
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料。
已知:CH3OH(l)+O2(g)= CO(g)+2H2O(g) 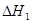 =-443.64
kJ·mol-1
=-443.64
kJ·mol-1
2CO(g)+ O2(g)= 2CO2(g) 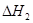 =
-566.0kJ·mol-1
=
-566.0kJ·mol-1
下列说法或热化学方程式正确的是
A.CO的燃烧热为566.0 kJ·mol-1
B.2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低
C.完全燃烧20g甲醇,生成二氧化碳和水蒸气时放出的热量为908.3 kJ
D.2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g)  =-1453.28
kJ·mol-1
=-1453.28
kJ·mol-1
查看答案和解析>>
科目: 来源:2013-2014学年河北石家庄市高考猜题化学试卷(解析版) 题型:实验题
某混合金属粉末,除Mg外,还含有Al、Zn中的一种或两种,含量都在10%以上.某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在.
所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O.
该小组探究过程如下:
●查阅资料:
|
①镁、铝、锌都是银白色的金属; ②锌(Zn)可以与NaOH溶液反应生成H2; ③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3·H2O; ④Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+. |
● 提出假设:
(1)假设①:该混合金属粉末中除镁外还含有________元素
假设②:该混合金属粉末中除镁外还含有________元素
假设③:该混合金属粉末中除镁外还含有铝、锌元素
●实验探究:
甲同学基于假设③设计实验方案如下:

乙同学同样基于假设3设计另一实验方案如下:

(2)试剂M是____________,沉淀B是_____________.
(2)试剂M是____________,沉淀B是_____________.
(3)丙同学认为乙同学的方案比甲同学的好,理由是_______________________.
(4)丁同学研究了甲、乙两同学的方案后,在其中一种方案的基础上用最简便方法测定了Wg样品中金属镁(Mg)的质量,他的方法是____________________________.
(5)操作Ⅰ的主要过程是:在滤液中逐滴加入_______________,直至生成的沉淀刚好溶解,再加入足量的____________________.
查看答案和解析>>
科目: 来源:2013-2014学年河北石家庄市高考猜题化学试卷(解析版) 题型:填空题
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是地壳中含量最高的金属,K是一种红棕色气体。

请填写下列空白:
(1)组成单质I的元素在周期表中的位置为 。
(2)欲检验F溶液中是否含有少量M,可选择的试剂为 (填化学式)。
(3)在反应⑦中还原剂与氧化剂的物质的量之比为___________________。
(4)某同学取F的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 。
(5)将化合物D 与KNO3、KOH 共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾).同时还生成KNO2和H2O 。该反应的化学方程式是__________________________。
(6)镁与I的合金是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、I单质在一定温度下熔炼获得。
①熔炼制备镁I合金时通入氩气的目的是 。
②I电池性能优越,I-Ag2O 电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为 。
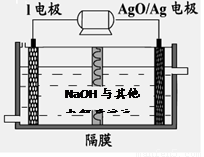
查看答案和解析>>
科目: 来源:2013-2014学年河北石家庄市高考猜题化学试卷(解析版) 题型:填空题
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
I. 已知:2CO(g)+ O2(g)=2CO2(g),ΔH=-566 kJ·mol-1
2Fe(s)+ 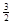 O2(g)=Fe2O3(s),ΔH=-825.5
kJ·mol-1
O2(g)=Fe2O3(s),ΔH=-825.5
kJ·mol-1
 反应:Fe2O3(s)+
3CO(g)
反应:Fe2O3(s)+
3CO(g)  2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
Ⅱ. 反应
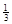 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
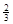 Fe(s)+ CO2(g)在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
Fe(s)+ CO2(g)在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
(1)CO的平衡转化率=____________.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________.
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+
2H2(g)  CH3OH(g).请根据图示回答下列问题:
CH3OH(g).请根据图示回答下列问题:
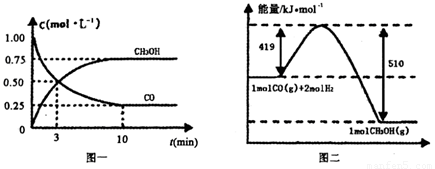
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________.
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
|
容器 |
反应物投入的量 |
反应物的 转化率 |
CH3OH的浓度 |
能量变化 (Q1、Q2、Q3均大于0) |
|
甲 |
1mol CO和2mol H2 |
α1 |
c1 |
放出Q1kJ热量 |
|
乙 |
1mol CH3OH |
α2 |
c2 |
吸收Q2kJ热量 |
|
丙 |
2mol CO和4mol H2 |
α3 |
c3 |
放出Q3kJ热量 |
则下列关系正确的是________.
A.c1=c2
B.2Q1=Q3
C.2a1=a3
D.a1 +a2 =1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
(3)若在一体积可变的密闭容器中充入l molCO、2molH2和1molCH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向________(填“正”、“逆”)反应方向移动.
(4)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式______________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com