
科目: 来源:2013-2014学年江西省稳派名校学术联盟高三12月调研考试理综化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的数值,则下列说法中,正确的是
A.常温下,0.1mol碳酸钠晶体中含有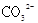 的个数为0.1NA
的个数为0.1NA
B.标准状况下,11.2L苯含有C-H键数目为3NA
C.常温常压下,54 g重水(D2O)含水分子数为3NA
D.将NA个Cl2分子通入足量的水中,所转移的电子总数为NA
查看答案和解析>>
科目: 来源:2013-2014学年江西省稳派名校学术联盟高三12月调研考试理综化学试卷(解析版) 题型:选择题
利用下列实验装置能完成相应实验的是
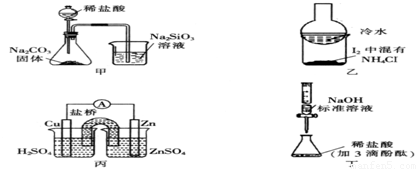
A.甲用于证明非金属性强弱:Cl>C>Si
B.乙用于分离I2和NH4Cl
C.丙装置能组成Zn、Cu原电池
D.丁用于测定某稀盐酸的物质的量浓度
查看答案和解析>>
科目: 来源:2013-2014学年江西省稳派名校学术联盟高三12月调研考试理综化学试卷(解析版) 题型:选择题
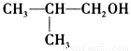 是某有机物与H2发生加成反应后的产物。符合该条件的稳定有机物共有
是某有机物与H2发生加成反应后的产物。符合该条件的稳定有机物共有
A.2种 B.3种 C.1种 D.4种
查看答案和解析>>
科目: 来源:2013-2014学年江西省稳派名校学术联盟高三12月调研考试理综化学试卷(解析版) 题型:选择题
下列反应中,相关坐标图错误的是
A B C D
向盐酸中滴入NaAlO2溶液 NaHSO4溶液中逐滴加入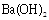 溶液 将铜粉加入到一定量浓硝酸中 将铁粉加入到一定量氯化铁溶液中
溶液 将铜粉加入到一定量浓硝酸中 将铁粉加入到一定量氯化铁溶液中
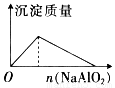
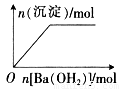


查看答案和解析>>
科目: 来源:2013-2014学年江西省稳派名校学术联盟高三12月调研考试理综化学试卷(解析版) 题型:实验题
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。探究二氧化硫的制取和性质都有着非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中S元素为-1价)在高温下和氧气反应制备SO2:

该反应中被氧化的元素是__________(填元素符号)。当该反应转移5.50mol电子时,生成的二氧化硫在标准状况下的体积为________L。
(2)①实验室可用70%的浓硫酸和亚硫酸钠反应制取二氧化硫,如果能控制反应速度,下图中可选用的发生装置是_______(填写字母)。
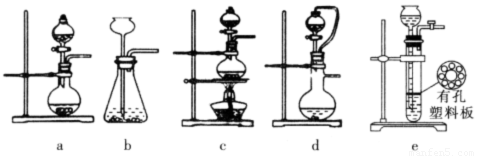
②若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,如果已有4.0%亚硫酸钠(质量分数)被氧化成硫酸钠,则至少需称取该亚硫酸钠_______g(保留一位小数)。
(3)某化学兴趣小组设计用如图装置验证二氧化硫的化学性质。
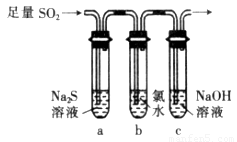
①能说明二氧化硫具有氧化性的实验现象为___________________________。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀
方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成
上述方案中合理的是________(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为______________。
查看答案和解析>>
科目: 来源:2013-2014学年江西省稳派名校学术联盟高三12月调研考试理综化学试卷(解析版) 题型:填空题
已知:A为淡黄色固体,E、X常温下为气体,A、B、C、D含有相同的金属离子,其转化关系如下图(部分产物已略去)。

请回答下列问题:
(1)B中所含化学键的类型是______________;
(2)常温常压下,7.8g A与足量的水充分反应放出热量a kJ,写出该反应的热化学方程式____________________。
(3)①C也可转化为B,写出该转化的化学方程式_______________;
②B与D反应的离子方程式为__________________________。
(4)将一定量的气体X通入2L B的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。

请回答:a点溶液中所含溶质的化学式为__________,b点溶液中各离子浓度由大到小的关系是___________________。
(5)将C溶液与氢氧化钡溶液混合可得不溶物F,F的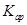 =2.5×
=2.5× 。现将该沉淀放入0.5 mol·
。现将该沉淀放入0.5 mol· 的BaCl2溶液中,其
的BaCl2溶液中,其 ________(填“增大”、“减小”或“不变”),组成不溶物F的阴离子在溶液中的浓度为________mol·
________(填“增大”、“减小”或“不变”),组成不溶物F的阴离子在溶液中的浓度为________mol· 。
。
查看答案和解析>>
科目: 来源:2013-2014学年江西省稳派名校学术联盟高三12月调研考试理综化学试卷(解析版) 题型:填空题
某化学兴趣小组利用废弃铝矿(含CuO、Al2O3及SiO2),模拟工业上提取铝的工艺,设计如下图所示的简单操作流程:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
|
|
|
|
开始沉淀 |
2.3 |
7.5 |
3.4 |
|
完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)滤渣主要成分的化学式为______________________。
(2)灼烧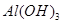 时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有___________(填仪器名称)。
时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有___________(填仪器名称)。
(3)溶液Y中要加入稍过量原料A,原料A的化学式是_________,步骤⑤反应的离子方程式是_______________________。
(4)操作流程中③的离子方程式为_______________________。
(5)铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如图所示:

请写出该电池正极反应式_________________;常温下,用该化学电源和惰性电极电解300mL氯化钠溶液(过量),消耗27mg Al,则电解后溶液的pH=_________(不考虑溶液体积的变化)。
(6)以熔融盐为电镀液可以在钢材表面镀铝,镀铝电解池中,钢材为________极;镀铝后能防止钢材腐蚀,其原因是____________________________________。
查看答案和解析>>
科目: 来源:2013-2014学年江西省稳派名校学术联盟高三12月调研考试理综化学试卷(解析版) 题型:填空题
氨有着广泛的用途,可用于化肥、硝酸、合成纤维等工业生产。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应可生成氨气:

该反应在固定体积的密闭容器中进行,有关说法正确的是_____________(填序号字母)。
A.反应处于平衡状态时,
B.反应达到平衡后,
C.体系的总压强不变,说明反应已达平衡
D.混合气体的密度保持不变,说明反应已达平衡
(2)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧试验机中相关的反应有:
 ①
①
 ②
②
 ③
③
请写出上述三个反应中 、
、 、
、 三者之间关系的表达式,
三者之间关系的表达式, =_________。
=_________。
(3)工业制硝酸的主要反应是:
 =
=
①升高温度,反应的K值减小,则Q______(填“>”、“<”或“=”)0。
②若反应起始的物质的量相同,下列关系图错误的是________(填序号)。


③在容积固定的密闭容器中发生上述反应,容器内部分物质的浓度如下表:
|
时间/浓度 |
|
|
|
|
|
起始 |
4.0 |
5.5 |
0 |
0 |
|
第2min |
3.2 |
a |
0.8 |
1.2 |
|
第4min |
2.0 |
3.0 |
2.0 |
3.0 |
|
第6min |
2.0 |
3.0 |
2.0 |
3.0 |
反应在第2 min到第4 min时,O2的平均反应速率为________。
反应在第2 min时改变了条件,改变的条件可能是______________________________。
该条件下,反应的平衡常数K=________。
查看答案和解析>>
科目: 来源:2013-2014学年江西省赣州市高三上学期期末联考理综化学试卷(解析版) 题型:选择题
化学与人类生活、生产和社会可持续发展密切相关。下列说法错误的是( )
A.煤的气化、液化是使煤变成清洁能源的有效途径
B.高纯硅可制作太阳能电池,二氧化硅可制作光导纤维
C.棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O
D.利用工业生产产生的二氧化碳制造全降解塑料,可以缓解温室效应
查看答案和解析>>
科目: 来源:2013-2014学年江西省赣州市高三上学期期末联考理综化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.无色溶液中:K+、Na+、Cu2+、SO42-
B.c(H+)/c(OH-)=1×10-14的溶液:K+、Na+、Cl-、SiO32-
C.由水电离出的C(OH-)=1×10-12 mol·L-1的溶液:NH4+、HCO3-、Na+、Cl-
D.c(OH-)=10-13 mol·L-1的溶液中:Al3+、NO3-、I-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com