
科目: 来源:2013-2014学年山东省新泰市高三上学期阶段化学试卷(解析版) 题型:填空题
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
五种元素原子半径最大是(写元素符号)
X与Z形成的化合物中,既含极性键又含非极性键的是(写分子式)————
由以上某些元素组成的化合物A、B、C、D有如下转化关系
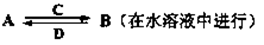
①其中C是溶于水显酸性的气体;D是淡黄色固体。写出C与D反应的化学方程式
②如果A由四种元素组成、B均由三种元素组成,B为两性不溶物,则A为(填名称)
由A与过量C反应转化为B的离子方程式
③如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。则B为(填化学式) 。A、B浓度均为0.1mol/L的混合溶液,碱性较强的是(填溶液名称)
查看答案和解析>>
科目: 来源:2013-2014学年山东省新泰市高三上学期阶段化学试卷(解析版) 题型:填空题
硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。
Ⅰ、硬质玻璃管常作为气体和固体反应的场所,如图(其他装置省略,必要时可加热)。

下列实验描述不正确的是
A、固体A为无水硫酸铜时,可以检验气体X中是否含有水蒸气
B、固体A为铜时,可以除去N2中的O2
C、在空气流作用下,加热氯化铁晶体得到纯净的无水氯化铁
D、将氨气和空气混合气通过灼热的铂丝,可看到有红棕色气体生成
Ⅱ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,
a、b、c三个棉球变化如下表。请填写表中的空白:

|
棉球 |
棉球上滴加的试剂 |
实验现象 |
解释和结论 |
|
a |
|
棉球变白,微热后又恢复红色 |
|
|
b |
含酚酞的NaOH溶液 |
棉球变为白色 |
离子方程式:
|
|
c |
|
棉球变为白色 |
结论:该气体具有 性 |
查看答案和解析>>
科目: 来源:2013-2014学年山东省新泰市高三上学期阶段化学试卷(解析版) 题型:填空题
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
|
温 度(℃) |
360 |
440 |
520 |
|
K值 |
0.036 |
0.010 |
0.0038 |
(1)①由上表数据可知该反应为放热反应,理由是 。
② 理论上,为了增大平衡时H2的转化率,可采取的措施是 。(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g)
+ H2O (g) CO(g)
+ 3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g)
+ 3H2(g) 获取,已知该反应中,当初始混合气中的 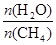 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
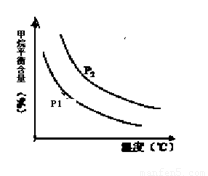
①图中,两条曲线表示压强的关系是:P1 P2(填“>”、“=”或“<”)。
②该反应为 反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CO(g) +
H2O(g) CO2
(g) + H2(g) 获取。
CO2
(g) + H2(g) 获取。
①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为 ,该温度下反应的平衡常数K值为 。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO) : n (H2O) : n (CO2) : n (H2)=1 : 16 : 6 : 6
查看答案和解析>>
科目: 来源:2013-2014学年山东省新泰市高三上学期阶段化学试卷(解析版) 题型:填空题
钠及其化合物具有广泛的用途。
 (1)工业上可利用反应Na(1)+ KCl(1)
K(g)+ NaCl(1)来治炼金属钾,此反应利用了钠的还原性及___
_____,
(1)工业上可利用反应Na(1)+ KCl(1)
K(g)+ NaCl(1)来治炼金属钾,此反应利用了钠的还原性及___
_____,
写出钠与TiCl4反应冶炼Ti的化学方程式______________ _______。
(2)用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破。该电池示意图如图:
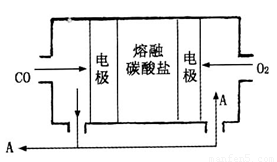
负极电极反应式为________________,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环。A物质的化学式为______________。
(3)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是
LiAlCl4-SOCl2。电池的总反应可表示为: 4Li + 2SOCl2 =4LiCl + S + SO2。
请回答下列问题:
①电池的负极材料为 ,发生的电极反应为 ;
②电池正极发生的电极反应为 ;
查看答案和解析>>
科目: 来源:2013-2014学年山东省新泰市高三上学期阶段化学试卷(解析版) 题型:填空题
以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐,电池总反应方程式为:C3H8 +5O2 = 3CO2+ 4H2O。
(1)已知: 2C3H8(g) + 7O2(g) = 6CO(g) + 8H2O(l) ∆H1
C(s) + O2(g) = CO2 (g) ∆H2
2C(s) + O2(g) = 2CO(g) ∆H3
则C3H8(g) +5O2((g) = 3CO2(g) + 4H2O(l) ∆H= (用∆H1 、∆H2 、∆H3表示)
(2)写出该电池正极的电极反应式: ,电池工作时CO32-移向 ;用该电池电解1000 mL 1mol/L的AgNO3溶液,此电解池的反应方程式为 ;当电池消耗0.005 mol C3H8时,被电解溶液的pH为 (溶液体积变化忽略不计)。
查看答案和解析>>
科目: 来源:2013-2014学年山东省日照市高三12月月考校际联合检测化学试卷(解析版) 题型:选择题
化学在生产和生活中有着重要的应用。下列说法正确的是
A.硫酸钡在医学上用作钡餐,Ba2+对人体无毒
B.“光化学烟雾”、“雾霾天气”、“温室效应”的形成都与氮氧化物无关
C.“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料
D.明矾[KAl(SO4)2.12H2O]水解时产生具有吸附性的胶体粒子,可作净水剂
查看答案和解析>>
科目: 来源:2013-2014学年山东省日照市高三12月月考校际联合检测化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.浓硝酸与足量铜片反应时,先生成红棕色气体,后生成无色气体
B.氧化铝的熔点很高,可用于制造熔融烧碱的坩埚
C.碳具有还原性,高温下能将二氧化硅还原为硅
D.饱和氯水既有酸性又有漂白性,加入NaHCO3漂白性增强
查看答案和解析>>
科目: 来源:2013-2014学年山东省日照市高三12月月考校际联合检测化学试卷(解析版) 题型:选择题
设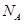 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,4g CH4含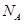 个共价键
个共价键
B.常温常压下,22.4L氦气含有的原子数为2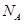
C.1molS在足量O2中燃烧,转移的电子数为6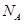
D.0.1 mol/L的碳酸氢钠溶液中含钠离子数为0.1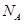 。
。
查看答案和解析>>
科目: 来源:2013-2014学年山东省日照市高三12月月考校际联合检测化学试卷(解析版) 题型:选择题
能大量存在于同一溶液中,当改变条件使水电离出的时c(H+)= mol/L,一定会发生反应的离子组是
mol/L,一定会发生反应的离子组是

查看答案和解析>>
科目: 来源:2013-2014学年山东省日照市高三12月月考校际联合检测化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
A.FeS固体溶于稀HNO3: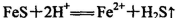
B.AlCl3和过量氨水反应: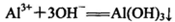
C.向AgCI悬浊液中滴加硫化钠溶液,白色沉淀变成黑色:
D.等体积等浓度的NaHSO4与Ba(OH)2溶液混合: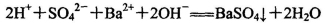
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com