
科目: 来源:2013-2014学年安徽省濉溪县高三第三次月考化学试卷(解析版) 题型:选择题
据国外媒体报道,iPhone5在电池方面有所改进,它将配备NEC自主研发的ORB超薄有机游离基电池,单次充电仅需30秒。该电池的一极为一种有机高分子的游离基(用R表示)和石墨粉及粘结剂的复合物,另一极是锂,分隔材料为某种聚烯烃,电解质为LiPF6溶解于某种有机碳酸酯溶剂中,高分子游离基在空气中十分稳定,在电池充电时被氧化成阳离子,而电池放电时又被还原成游离基。下列有关说法不正确的是
A.放电时,该电池是将化学能转化为电能
B.放电时,负极发生的反应是Li−e-=Li+
C.充电时,Rx+ 由阴极向阳极移动
D.充电时,阳极发生的反应是R−xe-=Rx+
查看答案和解析>>
科目: 来源:2013-2014学年安徽省濉溪县高三第三次月考化学试卷(解析版) 题型:选择题
将11.2g镁−铜合金完全溶于足量的稀硝酸中,充分反应后,向所得溶液中加入过量的NaOH溶液,产生21.4g沉淀。反应过程中产生NO的体积(标准状况下)为
A.4.48L B.6.72L C.11.2L D.13.44L
查看答案和解析>>
科目: 来源:2013-2014学年安徽省濉溪县高三第三次月考化学试卷(解析版) 题型:填空题
(1)铜是人类最早使用的金属之一,以下是冶炼铜的一个反应:
Cu2S+2Cu2O 6Cu+SO2
6Cu+SO2
该反应中被氧化的元素是 ,若反应中转移1mol电子,得到Cu mol。
(2)下列两种方法均可以制备CuSO4。
方法一:2Cu+O2 2CuO,CuO+H2SO4=CuSO4+H2O
2CuO,CuO+H2SO4=CuSO4+H2O
方法二:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
①假如某工厂欲生产CuSO4,请选择一种方法,并说明理由:
。
②有同学认为,生成等量的硫酸铜两种方法消耗的能量相同,因为反应都是铜转变为CuSO4,你认为上述说法 (填“正确”或“不正确”),原因是
。
查看答案和解析>>
科目: 来源:2013-2014学年安徽省濉溪县高三第三次月考化学试卷(解析版) 题型:填空题
(1)在298K时,1mol C2H6 在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ。写出该反应的热化学方程式 。
(2)利用该反应设计一个燃料电池:用KOH溶液作电解质溶液,多孔石墨作电极,在电极上分别通入乙烷和氧气。通入乙烷气体的电极应为 极(填“正”或“负”),该电极上发生的电极反应式为 。
(3)在右图所示实验装置中,石墨棒上的电极反应式为 。如果起始时盛有1L pH=5的CuSO4溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 。若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 。

(4)将普通碳钢钉放入“84消毒液”(NaClO溶液)中浸泡一段时间。预期的实验现象是 。
(5)为了进一步探究碳钢钉在该消毒液(NaClO)中的腐蚀原理,某同学设计了如图所示实验装置,写出碳(C)极上发生的电极反应式 。

查看答案和解析>>
科目: 来源:2013-2014学年安徽省濉溪县高三第三次月考化学试卷(解析版) 题型:填空题
铁和铝是两种重要的金属,它们的单质及其化合物有着各自的性质。
(1)现配制100mL 0.01mol∙L-1 FeCl3溶液,配制过程中需要的玻璃仪器除量筒、胶头滴管、烧杯外,还需要 ,配制过程中除需用FeCl3固体、蒸馏水外,还需要的试剂有 。将已配制好的溶液滴入沸水中并煮沸一段时间,可得到红褐色液体,该反应的离子方程式为 ,此液体具有的性质是 (填字母)。
a.光束通过该液体时形成光亮的“通路”
b.向该液体中加入AgNO3溶液,无沉淀产生
c.将该液体进行过滤,可得到红褐色固体
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(2)在隔绝空气的条件下,用镁条引燃Fe3O4粉末和铝粉的均匀混合物,使其充分反应。
①向充分反应后的剩余固体中加入足量的NaOH溶液,有大量气泡产生,所得剩余固体中除铁外还含有的固体物质是 (填化学式)。
②已知:3Fe(s)+2O2(g)=Fe3O4(s) △H=−1118 kJ·mol-1
2Al(s)+3/2O2(g)=Al2O3(s) △H=−1675.7 kJ·mol-1
则铝与Fe3O4发生反应生成铁和Al2O3的热化学方程式为
。
查看答案和解析>>
科目: 来源:2013-2014学年安徽省濉溪县高三第三次月考化学试卷(解析版) 题型:填空题
某学校化学兴趣小组为探究金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的AlCl3溶液和胆矾晶体(CuSO4∙5H2O),其实验方案如下:
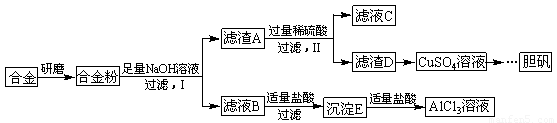
请回答下列问题:
(1)将合金研磨成合金粉的目的是 。
(2)分别写出步骤Ⅰ、Ⅱ中发生反应的化学方程式:
Ⅰ: ;
Ⅱ: 。
(3)在滤液B转化为沉淀E的过程中盐酸的用量不易控制,可将加入适量的盐酸改为通入一种气体,该气体的电子式为 ,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式: 。
(4)该小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣D中加入稀硫酸和H2O2可制得CuSO4,该反应的总化学方程式为 。
查看答案和解析>>
科目: 来源:2013-2014学年安徽省濉溪县高三第三次月考化学试卷(解析版) 题型:填空题
蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应为NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
(1)该蓄电池放电时,发生还原反应的物质是 (填字母,下同)。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)下列有关该电池的说法中正确的是
A.放电时电解质溶液显强酸性
B.放电时5.6g Fe全部转化为Fe(OH)2时,外电路中通过了0.2 mol电子
C.充电时阳极反应为Ni(OH)2+2OH-−2e-==NiO2+2H2O
D.充电时阴极附近溶液的碱性保持不变
(3)用此蓄电池电解含有0.01 mol CuSO4和0.01 mol NaCl的混合溶液100 mL,电解池的电极均为惰性电极。当溶液中的Cu2+ 全部转化成Cu时,阳极产生的气体在标准状况下的体积为 ;将电解后的溶液加水稀释至1L,此时溶液的pH= 。
(4)用此蓄电池进行电解,且电解池的电极均为铜电极,电解质溶液为浓碱液与NaCl溶液的混合液,电解一段时间后,同学们惊奇地发现,阳极附近不是生成蓝色沉淀,而是生成红色沉淀,查阅资料得知该红色沉淀是Cu2O。写出该阳极上的电极反应式: 。
查看答案和解析>>
科目: 来源:2013-2014学年安徽省濉溪县高三第三次月考化学试卷(解析版) 题型:实验题
某研究性学习小组拟探究在含Mg2+、Al3+ 的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程。
【实验】在0.1 mol∙L-1 MgSO4、0.05 mol∙L-1Al2(SO4)3的混合溶液中滴加0.5 mol∙L-1NaOH溶液,借助氢离子传感器和相应分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示。

(1)为精确控制加入NaOH溶液的体积,可将NaOH溶液置于 (填仪器名称)中滴加。
(2)图中有三个pH增加缓慢的阶段,第一阶段(a点前)对应的实验现象是 。
(3)对第二阶段(b、c之间)溶液pH变化缓慢的本质,小组同学做出如下推测,请补充推测2和3:
推测1:生成Mg(OH)2沉淀,消耗OH-;
推测2: ;
推测3: 。
若推测1符合实际情况,则a点之前反应的离子方程式为 ,请据此描述Mg(OH)2、Al(OH)3两种物质在水溶液中溶解性的差异 。
(4)请分析e点后溶液中较大量存在的含金属元素的离子并设计实验检验(可不填满):
|
较大量存在的含金属元素的离子 |
检验方法 |
|
|
|
|
|
|
|
|
|
查看答案和解析>>
科目: 来源:2013-2014学年安徽省濉溪县高三第四次月考化学试卷(解析版) 题型:选择题
化学来源于生活,应用于生活,渗透在生活的各个领域。下列有关物质的性质与应用的说法不相对应的是
A.明矾能水解生成Al(OH)3胶体,可用作净水剂
B.FeCl3溶液能与铜反应,可用于蚀刻印刷电路板
C.碳酸氢钠可与盐酸反应,可用作抗酸药
D.SiO2具有良好的导电性,可用作光导纤维
查看答案和解析>>
科目: 来源:2013-2014学年安徽省濉溪县高三第四次月考化学试卷(解析版) 题型:选择题
下列有关物质结构的说法正确的是
A.含有离子键的化合物一定是离子化合物
B.分子晶体中一定存在共价键
C.H2O2分子中既存在σ键又存在π键
D.晶体中分子间作用力越大,分子越稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com