
科目: 来源:2013-2014学年安徽省高三第三次月考化学试卷(解析版) 题型:选择题
将1 L 1.00 mol/L 的Na2CO3溶液逐滴加入到1 L 1.25 mol/L的盐酸中;再做相反操作:将1 L 1.25 mol/L的盐酸逐滴加入1 L 1.00 mol/L 的Na2CO3溶液中,两次操作产生的气体体积之比(同温同压下)是:( )
A.1∶1 B.2∶1 C. 5∶2 D.2∶5
查看答案和解析>>
科目: 来源:2013-2014学年安徽省高三第三次月考化学试卷(解析版) 题型:选择题
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8 mol,这些气体恰好能被500 mL 2 mol/L NaOH溶液完全吸收,发生的反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O、NO+NO2+2NaOH=2NaNO2+H2O。则生成的盐溶液中NaNO3的物质的量为( )
A. 0.2 mol B. 0.4 mol C. 0.6 mol D. 0.8 mol
查看答案和解析>>
科目: 来源:2013-2014学年安徽省高三第三次月考化学试卷(解析版) 题型:选择题
将铁、铝、硅的混合物分为等质量的两份,一份跟足量的NaOH溶液反应,另一份跟足量稀硫酸反应,最终产生的H2一样多,则铁与硅的物质的量之比为( )
A. 2:1 B.4:1 C.1:1 D.3:1
查看答案和解析>>
科目: 来源:2013-2014学年安徽省高三第三次月考化学试卷(解析版) 题型:选择题
Cl2、HCl的混合气体通入足量的氢氧化钠溶液,充分反应后分析产物溶液中除大量
OH− 外,还有Cl−、ClO−、ClO3−,并知这三种离子的物质的量比为9:2:1。
外,还有Cl−、ClO−、ClO3−,并知这三种离子的物质的量比为9:2:1。
试问原混合气体中Cl2与HCl体积比为( )
A.2:5
B.3:1  C.5:2
D.1:1
C.5:2
D.1:1
查看答案和解析>>
科目: 来源:2013-2014学年安徽省高三第三次月考化学试卷(解析版) 题型:填空题
Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,在短周期的所有元素中Q的原子半径与Z的原子半径之比最小(不包括稀有气体),R、X、Y三种元素的原子核外电子层数相同,同一周期中R的一种单质的熔点最高,Y与Q、R、X、Z均能形成多种常见化合物。
(1)X在周期表中的位置: ,其原子核外有 种不同形状的电子云。这五种元素中,最外层有两个未成对电子的元素是 (用元素符号表示)。
(2)常温下液态化合物甲只含上述元素中的两种,分子中原子个数比1︰1,甲的电子式是_______________。
(3)Q分别与X、Y形成的最简单化合物的稳定性______>______(用分子式表示)
(4)Q与R两元素可组成多种分子,其空间构型可能是 (填写序号)。
a.直线型 b.平面形 c.三角锥形 d.正四面体
(5)X的氧化物是形成光化学烟雾原因之一,工业上可采用它与其氢化物反应生成无毒害物质而除去,请用方程式表示该反应 。
查看答案和解析>>
科目: 来源:2013-2014学年安徽省高三第三次月考化学试卷(解析版) 题型:实验题
某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
(1)仪器a的名称为________;仪器b中可选择的试剂为________;

(2)实验室中利用下列各组物质,进行喷泉实验,不能成功的是( )
A.Cl2与饱和食盐水 B.CO2 与40%的NaOH溶液
C.NH3与饱和食盐水 D.HCl与水
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有还原性,写出相应的化学方程式______________________________ .
(4)E装置中浓硫酸的作用_______________________
(5)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)
查看答案和解析>>
科目: 来源:2013-2014学年安徽省高三第三次月考化学试卷(解析版) 题型:填空题
碳酸锂广泛应用于陶瓷和医药等领域,以锂辉石(主要成分为LiAlSi2O6)为原材料制备Li2CO3的工艺流程如下:

已知①2LiAlSi2O6+H2SO4 Li2SO4+Al2O3·4SiO2•H2O
Li2SO4+Al2O3·4SiO2•H2O
②Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、4.7、9.0和11.1
③某些物质的溶解度(S)如下表

请回答下列问题:
(1)锂辉石用浓硫酸浸取之前要粉碎成细颗粒的目的是 。
(2)滤液a中含有Li+、SO42-,另含有Fe3+、Al3+、Fe2+ 、 Mg2+ 、Ca2+ 、 Na+等杂质,步骤Ⅱ需在搅拌下加入石灰石以调节溶液的PH到6.0—6.5,此时沉淀的杂质离子有 ;石灰石调节溶液PH的原理的离子方程式为 。
(3)步骤Ⅱ在滤液a中加入的除杂剂依次为适量的H2O2溶液,石灰乳和Na2CO3溶液,发生氧化还原反应的离子方程式为 。
(4)步骤Ⅲ中加入饱和Na2CO3溶液过滤后需要用热水洗涤的原因是 。
(5)从滤液c中可回收的主要物质是 。
查看答案和解析>>
科目: 来源:2013-2014学年安徽省高三第三次月考化学试卷(解析版) 题型:实验题
某化学研究性学习小组探究Fe3+和SO32-之间发生的反应。
(1)取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。无气泡产生,无沉淀生成。这种红褐色液体是___________________。
(2)除了观察到以上的现象外,有成员提出了另一种可能:发生氧化还原反应。反应的离子方程式为 。
研究性学习小组设计了两种实验方案证明发生了氧化还原反应。请把实验方案补充完整:
方案一:检验溶液中含有Fe2+证明发生了氧化还原反应
方案二:检验溶液中含有 证明发生了氧化还原反应
实验用品:0.1mol/L BaCl2、3mol/L盐酸、0.1mol/LKMnO4(H+)、氯水、20%KSCN、0.5mol/LKI;试管若干、胶头滴管若干
Ⅰ预处理:将(1)中获得的混合物放在如图装置中处理足够时间。
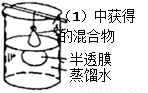
Ⅱ检验过程
|
操 作 |
现象及结论 |
|
基于方案一: |
|
|
基于方案二: |
|
查看答案和解析>>
科目: 来源:2013-2014学年安徽省濉溪县高三第三次月考化学试卷(解析版) 题型:选择题
化学在生产和日常生活中有着重要的作用。下列说法中不正确的是
A.工业上常用电解熔融的MgCl2制得金属镁
B.在海轮外壳上嵌入锌块,可减缓船体的腐蚀速率
C.世界各国流通的货币材质一般都是合金,合金中只含有金属元素
D.工业上用石灰对煤燃烧后形成的烟气进行脱硫,并能回收得到石膏
查看答案和解析>>
科目: 来源:2013-2014学年安徽省濉溪县高三第三次月考化学试卷(解析版) 题型:选择题
下列与化学反应能量变化相关的叙述正确的是
A.反应物的总能量一定高于生成物的总能量
B.铝与氧化铁反应既是氧化还原反应,又是吸热反应
C.化学反应中发生能量变化的根本原因是化学键的断裂与形成
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com