
科目: 来源:2013-2014学年学年北京市朝阳区高三上学期期中考试化学试卷(解析版) 题型:选择题
X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
|
|
X |
Y |
Z |
M |
R |
Q |
|
原子半径/nm |
|
|
0.186 |
0.074 |
0.099 |
0.143 |
|
主要化合价 |
|
-4,+4 |
|
-2 |
-1,+7 |
+3 |
|
其它 |
阳离子核 外无电子 |
无机非金属材料的主角 |
焰色反应呈黄色 |
|
|
|
下列说法正确的是
A.X与M形成的化合物中含有离子键
B.Z、M、Q三种元素的简单离子的半径:M>Z>Q
C.Y与R形成的化合物中R呈正价,说明Y的非金属性比R强
D.在元素周期表中,Q位于金属与非金属的交界处,可以作半导体材料
查看答案和解析>>
科目: 来源:2013-2014学年学年北京市朝阳区高三上学期期中考试化学试卷(解析版) 题型:选择题
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:
2N2O5(g)  4NO2 (g)+ O2(g)
ΔH > 0
4NO2 (g)+ O2(g)
ΔH > 0
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
|
时间/s |
0 |
500 |
100 0 |
150 0 |
|
c(N2O5)/ mol·L-1 |
5.00 |
3.52 |
2.50 |
2.50 |
下列说法中不正确的是
A.500 s内N2O5分解速率为2.96╳10-3mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)> 5.00 mol·L-1
查看答案和解析>>
科目: 来源:2013-2014学年学年北京市朝阳区高三上学期期中考试化学试卷(解析版) 题型:填空题
氯气在科技、生产中应用广泛。
(1)工业上常用熟石灰和氯气反应制取漂白粉,化学方程式是 。
(2)实验室用MnO2与浓盐酸反应制取氯气的原理如下:MnO2
+ 4HCl MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
①若制取11.2 L Cl2(标准状况),则最少应加入MnO2的质量为______g。
②用平衡移动原理解释可用排饱和食盐水法收集氯气的原因 。(结合必要的化学用语及文字回答)
③制备氯气时,可用NaOH溶液吸收尾气,下列试剂也可用于吸收氯气的是____(填字母)。
a. KI溶液 b. FeCl2溶液 c. KCl溶液
写出你选择的吸收试剂与Cl2反应的离子方程式:_______。
④也可用浓氨水吸收氯气,同时生成一种无污染的气体,反应的化学方程式是_______。
查看答案和解析>>
科目: 来源:2013-2014学年学年北京市朝阳区高三上学期期中考试化学试卷(解析版) 题型:填空题
KMnO4是一种重要的氧化剂。
(1)①在酸性条件下KMnO4的氧化性会增强。用来酸化KMnO4溶液的最佳试剂是 。
a.硝酸 b.硫酸 c.盐酸
②将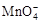 氧化C2O42−的离子方程式补充完整:
氧化C2O42−的离子方程式补充完整:
□MnO4− +□C2O42−+□ ==□Mn2+ +□CO2↑+□ 。
(2)某同学为了探究KMnO4溶液和Na2C2O4(草酸钠)溶液的反应过程,进行如下实验:
①配制100 mL 0.0400 mol·L-1的Na2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是 。
②将KMnO4溶液逐滴滴入一定体积的酸性Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如下:
|
滴入KMnO4溶液的次序 |
KMnO4溶液紫色褪去所需的时间 |
|
先滴入第1滴 |
60 s |
|
褪色后,再滴入第2滴 |
15 s |
|
褪色后,再滴入第3滴 |
3 s |
|
褪色后,再滴入第4滴 |
1 s |
请分析KMnO4溶液褪色时间变化的可能原因 。
③用配制好的0.040 0 mol·L-1的Na2C2O4溶液来标定某KMnO4溶液的浓度。每次准确量取25.00 mLNa2C2O4溶液,然后用酸化后的KMnO4溶液滴定。滴定三次分别消耗的KMnO4溶液的体积是20.00 mL、19.80 mL、20.20 mL,则KMnO4溶液的浓度为 。
查看答案和解析>>
科目: 来源:2013-2014学年学年北京市朝阳区高三上学期期中考试化学试卷(解析版) 题型:填空题
高纯硅生产流程如下:
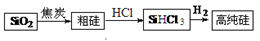
(1)由SiO2制粗硅的化学方程式是 ,该反应不能说明碳的非金属性强于硅,原因是 ,请写出一个能说明碳的非金属性强于硅的化学方程式 。
(2)900℃以上,H2与SiHCl3发生反应:SiHCl3(g)+
H2(g)  Si(s) + 3HCl(g) ΔH>0。将一定量的反应物通入固定容积的密闭容器中进行反应。下列说法正确的是
(填字母)。
Si(s) + 3HCl(g) ΔH>0。将一定量的反应物通入固定容积的密闭容器中进行反应。下列说法正确的是
(填字母)。
a.在恒温条件下,若容器内压强不变,则该反应一定达到化学平衡状态
b.增大SiHCl3的用量,可提高SiHCl3的平衡转化率
c.升高温度可加快反应速率,且提高硅的产率
(3)该流程中可以循环使用的物质是 。
查看答案和解析>>
科目: 来源:2013-2014学年学年北京市朝阳区高三上学期期中考试化学试卷(解析版) 题型:填空题
有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)氧化成硫酸盐。运用该原理生产铜和绿矾(FeSO4·7H2O)的流程如下:
回答下列问题:
(1)已知:
|
|
Fe2+ |
Cu2+ |
Fe3+ |
|
开始转化成氢氧化物沉淀时的pH |
7.6 |
4.7 |
2.7 |
|
完全转化成氢氧化物沉淀时的pH |
9.6 |
6.7 |
3.7 |
(1)加入CuO将溶液的pH调节到约为4,结合平衡移动原理解释该操作的原因 。
(2)写出能实现反应Ⅲ的化学方程式 。
(3)试剂b为 。
(4)欲从滤液中获得绿矾晶体,操作Ⅰ应为浓缩、 、 。
(5)反应Ⅰ的化学方程式 。
查看答案和解析>>
科目: 来源:2013-2014学年学年北京市朝阳区高三上学期期中考试化学试卷(解析版) 题型:填空题
根据表中信息回答下列问题。
|
元素 |
Si |
P |
S |
Cl |
|
单质与氢气 反应的条件 |
高温 |
磷蒸气与氢气能反应 |
加热 |
光照或点燃时发生爆炸而化合 |
(1)S在元素周期表中的位置是 。
(2)根据表中信息可知,Si、P、S、Cl 四种元素的的非金属性依次增强。用原子结构解释原因:同周期元素电子层数相同,从左至右, ,原子半径逐渐减小,得电子能力逐渐增强。
(3)25℃时,以上四种元素的单质与氢气反应生成l mol气态氢化物的反应热如下:
a.+34.3 kJ·mol-1 b.+9.3 kJ·mol-1 c.−20.6 kJ·mol-1 d.−92.3 kJ·mol-1
请写出固态白磷(P4)与H2反应生成气态氢化物的热化学方程式 。
(4)探究同主族元素性质的一些共同规律,是学习化学的重要方法之一。已知硒(Se)是人体必需的微量元素,其部分信息如图。
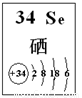
①下列有关说法正确的是 (填字母)。
a. 原子半径:Se>S>P b. 稳定性:H2Se>H2S
c. 因为酸性H2Se<HCl,所以非金属性Se<Cl
d. SeO2是酸性氧化物,能与烧碱溶液反应
②在下表中列出对H2SeO3各种不同化学性质的推测,举例并写出相应的化学方程式。
|
编号 |
性质推测 |
化学方程式 |
|
1 |
氧化性 |
H2SeO3+4HI=Se↓+2I2+3H2O |
|
2 |
|
|
|
3 |
|
|
查看答案和解析>>
科目: 来源:2013-2014学年学年北京市朝阳区高三上学期期中考试化学试卷(解析版) 题型:填空题
氢氧两种元素形成的常见物质有H2O与H2O2,在一定条件下均可分解。
(1)已知:
|
化学键 |
断开1mol化学键所需的能量(kJ) |
|
H—H |
436 |
|
O—H |
463 |
|
O=O |
498 |
①H2O的电子式是 。
②H2O(g)分解的热化学方程式是 。
③11.2 L(标准状况)的H2完全燃烧,生成气态水,放出 kJ的热量。
(2)某同学以H2O2分解为例,探究浓度与溶液酸碱性对反应速率的影响。常温下,按照如表所示的方案完成实验。
|
实验编号 |
反应物 |
催化剂 |
|
|
a |
50 mL 5% H2O2溶液 |
|
1 mL 0.1 mol·L-1 FeCl3溶液 |
|
b |
50 mL 5% H2O2溶液 |
少量浓盐酸 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
|
c |
50 mL 5% H2O2溶液 |
少量浓NaOH溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
|
d |
50 mL 5% H2O2溶液 |
|
MnO2 |
①测得实验a、b、c中生成氧气的体积随时间变化的关系如图1所示。

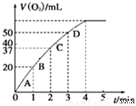
图1 图2
由该图能够得出的实验结论是_________。
②测得实验d在标准状况下放出氧气的体积随时间变化的关系如图2所示。解释反应速率变化的原因: 。
查看答案和解析>>
科目: 来源:2013-2014学年宁夏高三上学期第四次月考理综化学试卷(解析版) 题型:选择题
化学无处不在,下列与化学有关的说法,正确的是
A.纤维素在人体内可水解为葡萄糖,故可作人类的营养物质
B.侯氏制碱法的工艺过程中应用了物质溶解度的差异
C.碘是人体必须微量元素,所以要多多吃富含高碘酸的食物
D.氯化铝是一种电解质,可用于电解法制铝
查看答案和解析>>
科目: 来源:2013-2014学年宁夏高三上学期第四次月考理综化学试卷(解析版) 题型:选择题
下列物质分类正确的是
A.SO2、SiO2、 CO均为酸性氧化物
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.烧碱、冰醋酸、四氯化碳均为电解质
D.福尔马林、水玻璃、氨水均为混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com