
科目: 来源:2013-2014学年四川省攀枝花市高三第二次统考理综化学试卷(解析版) 题型:填空题
卤族元素的单质和化合物很多。
(1)卤素原子与氢原子形成的共价键中,极性最强键的是_____。NaF、MgF2 、SiF4三种晶体的熔点从高到低的顺序是______。
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____式发生。
A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(3)CH3Cl、BF3、SCl2三种分子中属于极性分子的是 ,ClO2-中心氯原子的杂化轨道类型为______,写出一种与SO32-互为等电子体的分子 。
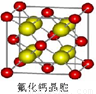
(4)已知CaF2晶体(见图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻最近的 两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
查看答案和解析>>
科目: 来源:2013-2014学年四川省攀枝花市高三第二次统考理综化学试卷(解析版) 题型:填空题
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率。
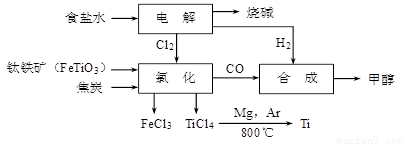
请回答下列问题:
(1)氢写出Ti原子的核外电子排布式______。
(2)写出钛铁矿在高温下与焦炭、氯气反应得到四氯化钛的化学方程式 。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因: 。
(4)由TiCl4→Ti 需要在Ar气中进行,反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
|
|
TiCl4 |
Mg |
MgCl2 |
Ti |
|
熔点/℃ |
-25.0 |
648.8 |
714 |
1667 |
|
沸点/℃ |
136.4 |
1090 |
1412 |
3287 |
(5)CH3OH(l)的燃烧热△H=-726.5kJ/mol,请写出甲醇燃烧的热化学方程式 。以甲醇和氧气(或空气)、电解液为Li2CO3和K2CO3的熔融物组成燃料电池,该电池负极反应式为__________________。
由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)= CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成9mol甲醇,至少需额外补充H2 mol。
查看答案和解析>>
科目: 来源:2013-2014学年四川省攀枝花市高三第二次统考理综化学试卷(解析版) 题型:填空题
研究二氧化硫、氮氧化物、PM2.5等大气污染物的治理具有重要意义。
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样中除H+和OH﹣外其它水溶性离子的化学组分及其平均浓度如下表:
|
离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3﹣ |
Cl﹣ |
|
浓度/mol·L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断试样的pH =
(2)含SO2的工业废气处理:废气的将含有SO2的废气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,在废气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。
二氧化碳与石灰石浆液反应得到的产物为 。
亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式为 。
(3)汽车尾气中NOx和CO的生成及转化。
①已知气缸中生成NO的反应为:N2(g)+O2(g) 2NO(g)
2NO(g)  H>0
H>0
汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。
②在汽车尾气系统中安装催化转化器,使NO和CO迅速发生反应转化成对环境无污染的气体,可减少CO和NO的污染,反应的化学方程式为 。
(4)用CH4催化还原NOx可消除氮的氧化物的污染。例如:
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol—1
CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol—1
H2O(g)= H2O(l)△H=-144kJ·mol—1
取标准状况下4.48LCH4还原NO2和NO的混合物,若氮氧化物完全被还原,且生成H2O(l),则放出的总热量Q的取值范围是 。
查看答案和解析>>
科目: 来源:2013-2014学年四川省攀枝花市高三第二次统考理综化学试卷(解析版) 题型:实验题
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
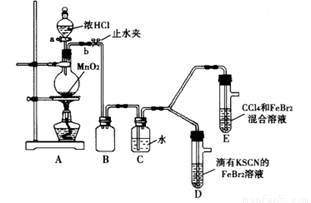
(1)①连接仪器:把玻璃导管插入橡胶塞的操作是: ,然后对准橡胶塞上得空稍稍用力转动,将其插入。
②检查气体发生装置A的气密性的操作是: ,向分液漏斗中注水,若水不能顺利流下,则气密性良好。
(2)整套实验装置存在一处明显不足,请指出 。
用改正后的装置进行实验。实验过程如下:

(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化:
D装置中:红色慢慢褪去。
E装置中:CC14层先由无色变为橙色,后颜色逐渐变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:

①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因 ,请设计简单实验证明上述解释: 。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因 。
查看答案和解析>>
科目: 来源:2013-2014学年四川省眉山市高三第一次诊断性考试化学试卷(解析版) 题型:选择题
化学与生活、社会密切相关。下列说法正确的是
A.光纤通信所使用的光缆的主要成分是晶体Si,太阳能电池使用的常用材料主要是SiO2
B.我国重点城市近年来已发布“空气质量日报”,将CO2、NO2和可吸入颗粒物等列入了首要污染物
C.太阳光透过树叶间的缝隙射入密林中的光柱的形成属于丁达尔效应
D.SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等
查看答案和解析>>
科目: 来源:2013-2014学年四川省眉山市高三第一次诊断性考试化学试卷(解析版) 题型:选择题
下列有关化学实验的叙述中,正确的是
A.实验室氢氧化钠溶液应保存在带橡胶塞的试剂瓶中
B.做钠盐溶液的焰色反应时,用玻璃棒蘸取待测液放在酒精灯火焰上灼烧
C.中和滴定实验中用待测液润洗锥形瓶
D.向试管中滴加液体时,胶头滴管紧贴试管内壁
查看答案和解析>>
科目: 来源:2013-2014学年四川省眉山市高三第一次诊断性考试化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.NaHCO3溶液中的水解:HCO3-+H2O H3O++CO32-
H3O++CO32-
B.氯化铁溶液中通入硫化氢:2Fe3++H2S=2Fe2++S↓+2H+
C.CaCl2 溶液中通入CO2: Ca2++CO2+H2O=CaCO3↓+2H+
D.NaHSO4溶液中逐滴加入Ba(OH)2溶液至恰好呈中性:
Ba2++OH-+H++SO42-=BaSO4↓+H2O
查看答案和解析>>
科目: 来源:2013-2014学年四川省眉山市高三第一次诊断性考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1 NA
B.100ml 18.4mol/L的浓硫酸与足量铜加热充分反应后生成SO2的数目为0.92 NA
C.密闭容器中盛有0.1molN2和0.3molH2,充分反应后转移电子的数目为0.6NA
D.80 g NH4NO 3晶体中含有NH4+ 数目为NA
查看答案和解析>>
科目: 来源:2013-2014学年四川省眉山市高三第一次诊断性考试化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、A、B、C在元素周期表的位置如图所示,A是电负性最大的元素,则下列说法不正确的是
|
X |
|
|
A |
|
Y |
|
C |
B |
A.原子半径由小到大的顺序为:A<B<C<Y
B.A、B的氢化物的沸点由低到高的顺序为:HA<HB
C.X、Y最高价氧化物对应的水化物的酸性由弱到强的顺序为:H2YO3<H2XO3
D.B、C简单离子的还原性由弱到强的顺序为:B-<C2-
查看答案和解析>>
科目: 来源:2013-2014学年四川省眉山市高三第一次诊断性考试化学试卷(解析版) 题型:选择题
下列溶液中有关物质的量浓度关系正确的是
A.将0.2 mol/L的某一元弱酸HA溶液和0.1 mol/LNaOH溶液等体积混合,则充分反应后的混合液中:2c(OH-)+c(A-)=2c(H+)+c(HA)
B.pH相等的CH3COONa溶液、C6H5ONa溶液、NaHCO3溶液和NaOH溶液,其物质的量浓度由小到大的顺序为:c (NaOH)<c(CH3COONa)<c (NaHCO3)<c (C6H5ONa)
C.常温下,将pH=2.0的CH3COOH溶液和pH=12.0的NaOH溶液等体积混合,则充分反应后的混合液中:c (Na+)>c (CH3COO-)>c(OH-)>c (H+)
D.常温下,向10mL pH=4.0的醋酸溶液中加入水稀释后,溶液中c(H+)、c(OH-)、c (CH3COOH)/c (CH3COO-)都将要变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com