
科目: 来源:2013-2014学年北京市朝阳区高三上学期期末考试化学试卷(解析版) 题型:填空题
SO2是一种重要的化工原料,也是一种环境污染物。
(1)SO2可用于工业制Br2过程中吸收潮湿空气中的Br2,反应的离子方程式是 。
(2)直接排放含SO2的烟气会形成酸雨,危害环境。用化学方程式表示SO2形成硫酸型酸雨的反应: 。
(3)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol•L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
①此时溶液中c(SO32-)的浓度是0.2 mol•L-1,则溶液中c(HSO3-)是_________mol•L-1,由此说明NaHSO3溶液显 性,用化学平衡原理解释: 。
②向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是 。
查看答案和解析>>
科目: 来源:2013-2014学年北京市朝阳区高三上学期期末考试化学试卷(解析版) 题型:填空题
氨在国民经济中占有重要地位。
(1)工业合成氨时,合成塔中每产生1 mol NH3,放出46.1 kJ的热量。
① 工业合成氨的热化学方程式是 。
② 已知:
N2 (g) 2N
(g)
2N
(g)
H2 (g)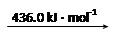 2H
(g)
2H
(g)
则断开1 mol N-H键所需的能量是_______kJ。
(2)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。

① 曲线a对应的温度是 。
② 关于工业合成氨的反应,下列叙述正确的是 (填字母)。
A. 及时分离出NH3可以提高H2的平衡转化率
B. 加催化剂能加快反应速率且提高H2的平衡转化率
C. 上图中M、N、Q点平衡常数K的大小关系是K(M)= K(Q) >K(N)
③ M点对应的H2转化率是 。
 (3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:
4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g)。
则该燃料电池的负极反应式是 。
查看答案和解析>>
科目: 来源:2013-2014学年北京市朝阳区高三上学期期末考试化学试卷(解析版) 题型:填空题
用含有Al2O3及少量Fe2O3和SiO2的铝土矿制备净水剂——液体聚合硫酸铝铁,工艺流程如下(部分操作和条件略):
I.向铝土矿中加入过量H2SO4后,加热、搅拌、过滤。
II.向滤液中加入一定量的FeSO4·7H2O和双氧水。
III.向溶液中加入Ca(OH)2固体,调节溶液的pH约为1,过滤。
IV.加入稳定剂,加热,得到产品。
(1)Fe2O3与H2SO4反应的离子方程式是___________。
(2)步骤I中过滤得到的滤渣成分是________(填化学式)。
(3)步骤I 中H2SO4的浓度与反应温度会影响铁与铝的浸出率。根据下图分析,步骤I 中H2SO4浓度的适宜范围是__________,反应的适宜温度是_________。
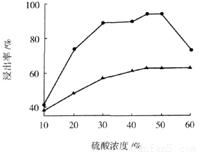
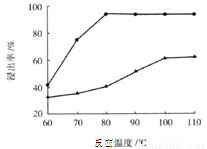

(4)步骤II中增大n(Fe3+)的离子方程式是_________。
(5)步骤III得到碱式硫酸铝铁[AlFe(OH)n(SO4)m]的溶液,则步骤II中应增大n(Fe3+)到
n(Al3+)﹕n(Fe3+)= 。
(6)研究表明,液体聚合硫酸铝铁的纯度越高,净水效果越好。已知:
一些物质在20℃时的溶解度
|
物质 |
Ca(OH)2 |
CaSO4 |
Na2SO4 |
|
溶解度/g |
0.153 |
0.258 |
19.5 |
结合表中数据,解释步骤III中使用Ca(OH)2而不用NaOH的原因__________。
(7)铝土矿也可用于冶炼金属Al。以金属Al作阳极,稀硫酸作电解液,通过电解会使金属Al的表面生成致密坚硬的氧化膜,其电极反应式是_________。
查看答案和解析>>
科目: 来源:2013-2014学年北京市朝阳区高三上学期期末考试化学试卷(解析版) 题型:填空题
以A为原料合成安眠药——苯巴比妥的路线如下:
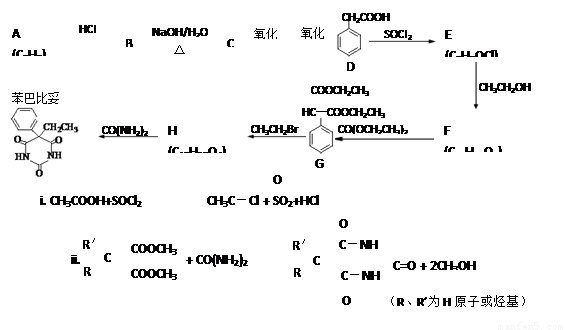
已知:
(1)A中官能团的名称是 。
(2)B→C的化学方程式是 。
(3)写出一种与D互为同分异构体,且苯环上只有一个取代基的酯的结构简式 。
(4)F为酯,其结构简式是 。
 (5)F→G的反应类型是
。
(5)F→G的反应类型是
。
(6)H的结构简式是 。
(7)G与CO(NH2)2在一定条件下合成的高分子结构简式是 。
查看答案和解析>>
科目: 来源:2013-2014学年北京市朝阳区高三上学期期末考试化学试卷(解析版) 题型:填空题
甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
|
步骤 |
操作 |
现象 |
|
I |
向2 mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 |
溶液由棕黄色变为红褐色, 并有少量刺激性气味的气体逸出 |
(1)常温下,FeCl3溶液的pH_______7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
① 甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因:________。
② 乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:
Fe3+ + SO32-
+
SO32-
+ =
= F
e2+ +
F
e2+ + +
+

乙同学查阅资料得知:
|
1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3; 2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。 |
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成了如下实验:
|
步骤 |
操作 |
现象 |
|
II |
用激光笔照射步骤I中的红褐色溶液 |
出现“丁达尔效应” |
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是________。
(4)为进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成了如下实验:
|
步骤 |
操作 |
现象 |
|
III |
向1 mol•L-1的FeCl3溶液中通入一定量的SO2 |
溶液由黄色变为红褐色 |
|
IV |
用激光笔照射步骤III中的红褐色溶液 |
没有出现“丁达尔效应” |
① 经检验步骤III中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是_________(填字母)。
a.K3[Fe(CN)6] 溶液 b.KSCN溶液 c.KMnO4溶液
② 已知H2SO3是弱酸,请结合电离方程式说明步骤III中出现红褐色的原因: 。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
查看答案和解析>>
科目: 来源:2013-2014学年北京市海淀区高三上学期期末考试化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.棉花、羊毛、腈纶和涤纶都属于合成纤维
B.明矾可用作除去污水中悬浮颗粒的混凝剂
C.使用青霉素前一定要进行皮肤敏感试验
D.利用油脂在碱性溶液中的水解可制取肥皂
查看答案和解析>>
科目: 来源:2013-2014学年北京市海淀区高三上学期期末考试化学试卷(解析版) 题型:选择题
下列事实所对应的方程式不正确的是
A.盛放氢氧化钠溶液的试剂瓶不能用玻璃塞:SiO2+2NaOH=Na2SiO3+H2O
B.高温下铁与水蒸气反应生成保护膜:2Fe+6H2O(g)
 2Fe(OH)3+3H2
2Fe(OH)3+3H2
C.工业制取漂粉精:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
D.实验室制取氨气:2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+ 2H2O
CaCl2+2NH3↑+ 2H2O
查看答案和解析>>
科目: 来源:2013-2014学年北京市海淀区高三上学期期末考试化学试卷(解析版) 题型:选择题
氯霉素主要成分的结构简式为: ,下列有关该化合物的说法不正确的是
,下列有关该化合物的说法不正确的是
A.属于芳香族化合物 B.能发生水解反应
C.不能发生消去反应 D.能发生催化氧化
查看答案和解析>>
科目: 来源:2013-2014学年北京市海淀区高三上学期期末考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子能大量共存的是
A.pH=12的溶液中:K+、Na+、Br-、AlO2-
B.无色溶液中:H+、K+、MnO4-、C2O42-
C.c(Fe3+)=0.1 mol·L-1的溶液中:K+、H+、SCN-、I-
D.由水电离出的c(OH-) =1.0×10-13 mol·L-1的溶液中:Na+、NH4+、SO42-、HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com