
科目: 来源:2013-2014学年云南省毕业生复习统一检测理综化学试卷(解析版) 题型:选择题
下列物质分类正确的是
A.SO2、SiO2、CO均为酸性氧化物
B.福尔马林、水玻璃、氨水均为混合物
C.烧碱、冰醋酸、四氯化碳均为电解质
D.稀豆浆、硅酸、氯化铁溶液均为胶体
查看答案和解析>>
科目: 来源:2013-2014学年云南省毕业生复习统一检测理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.硝基苯的结构简式为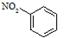
B.表示甲烷分子或四氯化碳分子的比例模型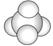
C.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
D.结构片段为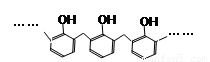 的高聚物,其单体是甲醛和苯酚
的高聚物,其单体是甲醛和苯酚
查看答案和解析>>
科目: 来源:2013-2014学年云南省毕业生复习统一检测理综化学试卷(解析版) 题型:选择题
如图是立方烷的球棍模型,下列有关说法不正确的是
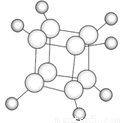
A.其一氯代物只有一种同分异构体
B.其二氯代物有三种同分异构体
C.它的分子式不符合CnH2n+2,所以它不是饱和烃
D.它与苯乙烯(C6H5—CH=CH2)互为同分异构体
查看答案和解析>>
科目: 来源:2013-2014学年云南省毕业生复习统一检测理综化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.溶液中由水电离的氢离子浓度为1×10-11 mol/L:K+、Na+、SO42- 、NO3-
B.使酚酞变红色的溶液:Na+、Cu2+、HCO3- 、NO3-
C.0. 1 mol·L-1AgNO3 溶液:H+、K+、SO42- 、I-
D.0. 1 mol·L-1NaAlO2 溶液: H+、Na+、Cl-、SO42-
查看答案和解析>>
科目: 来源:2013-2014学年云南省毕业生复习统一检测理综化学试卷(解析版) 题型:选择题
工业上焙烧明矾[ KAl(SO4)2·12H2O]的化学方程式为:
4 KAl(SO4)2·12H2O+3S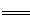 2K2SO4+2Al2O3
+9SO2 +48H2O,下列判断正确的是
2K2SO4+2Al2O3
+9SO2 +48H2O,下列判断正确的是
A.在焙烧明矾的反应中,还原剂与氧化剂的物质的量之比是3:4
B.最后得到的K2SO4溶液呈中性,所以c(K+)=c(SO42-)
C.焙烧产生的SO2可用于制硫酸,焙烧948 t明矾(M= 474 g/mol),若SO2的利用率为96%,可生产质量分数为98%的硫酸432 t
D.工业上冶炼Al2O3制得Al,以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是
Al+3NiO(OH)+NaOH 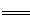 NaAlO2+3Ni(OH)2
NaAlO2+3Ni(OH)2
查看答案和解析>>
科目: 来源:2013-2014学年云南省毕业生复习统一检测理综化学试卷(解析版) 题型:选择题
煅烧硫酸镁的过程中存在以下反应:
2MgSO4+C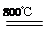 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C  MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。
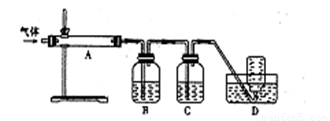
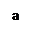
 b中盛放的溶液和d中收集的气体判断正确的一组是
b中盛放的溶液和d中收集的气体判断正确的一组是
A.NaOH溶液 CO B.Na2CO3溶液 SO2
C.稀硝酸 S D.KMnO4溶液 CO
查看答案和解析>>
科目: 来源:2013-2014学年云南省毕业生复习统一检测理综化学试卷(解析版) 题型:选择题
用惰性电极电解某金属元素R的硝酸盐R(NO3)n溶液,通电一段时间后,阳极产生气体V L(标准状况)时,阴极质量增加m g,若R的相对原子质量为M,设NA 为阿伏加德罗常数的值,下列叙述中不正确的是
A.电路中通过电子 NA
B.n =
NA
B.n = 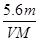
C.溶液中H+增加 NA
D.n =
NA
D.n = 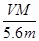
查看答案和解析>>
科目: 来源:2013-2014学年云南省毕业生复习统一检测理综化学试卷(解析版) 题型:填空题
铜及其化合物在生产、生活中有广泛的应用。
Ⅰ、铜可采用如下方法制备:
方法一:火法炼铜:Cu2S +
O2 2Cu + SO2
2Cu + SO2
方法二:湿法炼铜: CuSO4 + Fe FeSO4 + Cu
上述两种方法中,你认为哪种方法更好 ,原因是 (写出1条原因即可)。分别用火法炼铜与湿法炼铜生产640gCu,则转移的电子数之比为 。
Ⅱ、印刷电路板上使用的铜需要回收利用。
用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O晶体,实验室模拟回收过程如下:
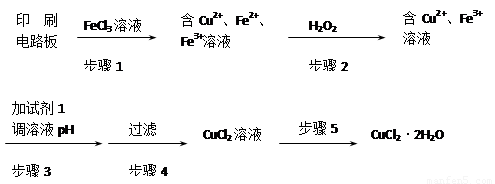
①步骤2中反应的离子方程式是 。
②步骤5中蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是________________ (用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O晶体。
③步骤4中洗涤沉淀的操作为
④步骤3中可选用的“试剂1”是 (写出一种即可),目的是使溶液的pH升高到4,此时Fe3+浓度为 [Ksp(Fe(OH)3)=4×10-38]。
查看答案和解析>>
科目: 来源:2013-2014学年云南省毕业生复习统一检测理综化学试卷(解析版) 题型:实验题
(15分)硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。请填写表中的空白:

|
棉球 |
棉球上滴加的试剂 |
实验现象 |
解释和结论 |
|
a |
|
棉球变白,微热后又恢复红色 |
|
|
b |
含酚酞的NaOH溶液 |
棉球变为白色 |
离子方程式: |
|
c |
|
棉球变为白色 |
该气体具有 (选填“氧化性”或“还原性”) |
Ⅱ、硬质玻璃管与其它装置结合完成定性或定量实验。下图是某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究的装置。

实验一:铁矿石中含氧量的测定
(1)按上图组装仪器(夹持仪器均省略),检查装置的气密性;
(2)将10.0g铁矿石放入硬质玻璃管中;
(3)从左端导气管口处不断地缓缓通入H2, 后,点燃A处酒精灯;
(4)充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(5)测得反应后装置B增重2.70g,则铁矿石中氧的质量分数为______________________。
实验二:铁矿石中含铁量的测定

(1)步骤②和⑤中都要用到的玻璃仪器是 __。
(2)下列有关步骤⑥的操作中说法不正确的是_______。
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
实验结论:推算铁的氧化物的组成,由实验一、二得出该铁矿石中铁的氧化物的化学式为
查看答案和解析>>
科目: 来源:2013-2014学年云南省毕业生复习统一检测理综化学试卷(解析版) 题型:填空题
2013年12月2日,我国在西昌卫星发射中心用“长征三号甲”运载火箭将“嫦娥三号”探月卫星成功送入太空,进一步向广寒宫探索。“长征三号甲”是三级液体助推火箭,一、二级为常规燃料,常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。
Ⅰ.常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) △H = -543kJ·mol-1
 H2(g)+
H2(g)+  F2(g)
= HF(g) △H = -269kJ·mol-1
F2(g)
= HF(g) △H = -269kJ·mol-1
H2(g)+  O2(g)
= H2O(g) △H = -242kJ·mol-1
O2(g)
= H2O(g) △H = -242kJ·mol-1
请写出肼和氟气反应的热化学方程式:_____________________________。
Ⅱ.氧化剂二氧化氮可由NO和 O2生成,已知在2 L密闭容器内,800 ℃时反应:
2NO(g)+O2(g) 2NO2(g)
ΔH 的体系中,n(NO)随时间的变化如表:
2NO2(g)
ΔH 的体系中,n(NO)随时间的变化如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.200 |
0.100 |
0.080 |
0.050 |
0.050 |
0.050 |
|
n(O2)(mol) |
0.100 |
0.050 |
0.040 |
0.025 |
0.025 |
0.025 |
(1) 已知:K800℃>K1000℃,则该反应的ΔH ______0(填“大于”或“小于”),用O2表示从0~2 s内该反应的平均速率为__________。
(2)能说明该反应已达到平衡状态的是________。
a.容器内颜色保持不变 b. 2v逆(NO)=v正(O2)
c.容器内压强保持不变 d.容器内密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有 。
(4)在上述条件下,计算通入2 mol NO和1 mol O2的平衡常数K=______________。
(5)在上述条件下,若开始通入的是0.2 mol NO2气体,达到化学平衡时,则NO2的转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com