
科目: 来源:2013-2014学年上海市闸北区高三上学期期末考试化学试卷(解析版) 题型:选择题
使用类似数轴的方法研究一些化学问题可以收到的直观形象的效果。下列表达正确的
A.Fe在Cl2中的燃烧产物: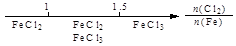
B.氨水与SO2反应后溶液中的铵盐:
C.平衡常数与转化率关系:
D.Cl2与CH4取代反应后的产物: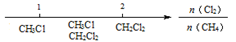
查看答案和解析>>
科目: 来源:2013-2014学年上海市闸北区高三上学期期末考试化学试卷(解析版) 题型:选择题
下表是不同pH环境时某浓度铬酸(H2CrO4)溶液中,离子浓度(mol/L)与pH的关系,下列说法错误的是
|
pH |
c(CrO42—) |
c(HCrO4—) |
c(Cr2O72—) |
c(H2CrO4) |
|
4 |
0.0003 |
0.1040 |
0.4480 |
0 |
|
6 |
0.0319 |
0.0999 |
0.4370 |
0 |
|
7 |
0.2745 |
0.0860 |
0.3195 |
0 |
|
9 |
0.9960 |
0.0031 |
0.0004 |
0 |
A.铬酸第一级电离方程式为H2CrO4
 H++HCrO4—
H++HCrO4—
B.要得到CrO42—应控制溶液的pH>9
C.当电离达到平衡时,2v(正)(HCrO4—)= v(逆)(Cr2O72—)
D.该铬酸溶液的物质的量浓度约为1.00mol/L
查看答案和解析>>
科目: 来源:2013-2014学年上海市闸北区高三上学期期末考试化学试卷(解析版) 题型:选择题
C和CuO在一定温度下反应,产物有Cu、Cu2O、CO、CO2。将1.20 g C跟16.0 g CuO混合,隔绝空气加热,将生成的气体全部通过足量的澄清石灰水,反应一段时间后共收集到1.12 L气体(标准状况),生成沉淀的质量为5.00 g。下列说法正确的是
A.反应后的固体混合物中还含有碳
B.反应后的固体混合物总质量为13.6 g
C.反应后的固体混合物中氧化物的物质的量为0.05 mol
D.反应后的固体混合物中单质Cu的质量为12.8 g
查看答案和解析>>
科目: 来源:2013-2014学年上海市闸北区高三上学期期末考试化学试卷(解析版) 题型:填空题
已知元素M是组成物质NH4Al(SO4)2的一种元素。元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如下表所示:
|
|
I1 |
I2 |
I3 |
I4 |
|
电离能(kJ/mol) |
578 |
1817 |
2745 |
11578 |
(1)元素M的名称是_______________;
(2)硫原子核外有______种不同运动状态的电子,有______种不同形状的电子云;
(3)请用一个事实证明氧气的氧化性比硫的氧化性强:______________________________。
(4)相同条件下,0.1 mol/L NH4Al(SO4)2中c(NH4+)________(填“等于”、“大于”或“小于”)0.1 mol/LNH4HSO4中c(NH4+)。
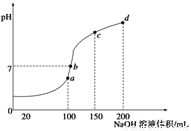
(5)室温时,向100 mL 0.1 mol/LNH4HSO4溶液中滴加0.1 mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
①试分析图中a、b、c、d四个点,水的电离程度最大的是____________;
②在b点,溶液中各离子浓度由大到小的排列顺序是________;
③在c d段发生反应的离子方程式_________________。
查看答案和解析>>
科目: 来源:2013-2014学年上海市闸北区高三上学期期末考试化学试卷(解析版) 题型:填空题
铁及其化合物在生产、生活中有广泛应用。请回答下列问题:
(1)水热法制备Fe3O4纳米颗粒的反应是:3Fe2++2S2O32-+O2+xOH-→Fe3O4↓+S4O32-+2H2O
①上述离子方程式中x=________;
②每生成1 mol Fe3O4,反应转移的电子为________mol;
(2)某高效净水剂可由Fe(OH)SO4聚合得到。工业上以FeSO4、NaNO2和稀硫酸为原料来制备Fe(OH)SO4,反应中有NO生成,化学方程式为 。
高炉炼铁过程中发生的主要反应为: Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)

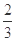 Fe(s)+CO2(g)+Q
Fe(s)+CO2(g)+Q
已知该反应在不同温度下的平衡常数如下:
|
温度/℃ |
1000 |
1115 |
1300 |
|
平衡常数 |
4.0 |
3.7 |
3.5 |
(3)该反应的平衡常数表达式K=_ ;Q 0(填“>”、“<”或“=”);
(4)欲提高上述反应中CO的平衡转化率,可采取的措施是 ;
A.提高反应温度 B.移出部分CO2
C.加入合适的催化剂 D.减小容器的容积
(5)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,此时v正 v逆(填“等于”、“大于”或“小于”)。经过l0 min,在1000℃达到平衡,则该时间范围内反应的平均反应速率v (CO2)= 。
查看答案和解析>>
科目: 来源:2013-2014学年上海市闸北区高三上学期期末考试化学试卷(解析版) 题型:实验题
某化学课外活动小组的同学在学习NH3的性质时讨论:既然NH3具有还原性,能否像H2那样还原CuO呢?于是他们设计了如下实验装置(夹持装置未画出)进行实验。

请回答下列问题:
(1)仪器a的名称为______________;仪器b中可选择的试剂为______________;
(2)实验中观察到装置C中黑色CuO粉末变为红色固体,干燥管D增重,量气管内收集到无色无味的单质气体,上述现象可以证明NH3具有________性,写出相应的化学方程式_____________;
(3)E装置中浓硫酸的作用是________________________________
(4)读取气体体积前,应对装置F进行的操作是:________________________若读数时,量气管中的液面低于水准管的液面,则量气管中气体的体积将_____。(填“偏大”、“偏小”或“不变”)。
(5)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物,在酸性溶液中,Cu+易发生自身的氧化还原反应(2Cu+ →Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O: 。
(6)此套实验装置还可用于测定氨气的分子组成。若实验完毕,测得干燥管D增重m克,装置F测得气体的体积为n升(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)
查看答案和解析>>
科目: 来源:2013-2014学年上海市闸北区高三上学期期末考试化学试卷(解析版) 题型:实验题
硫酸亚锡(SnSO4)是一种重要的硫酸盐,主要用于电镀工业的镀锡、铝合金表面的氧化着色、印染工业的媒染剂、双氧水去除剂等。某研究小组设计SnSO4制备路线如下:

查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成难溶物Sn(OH)Cl(碱式氯化亚锡)。
请回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 。
(2)加入Sn粉的作用有两个:①调节溶液pH ② 。
(3)反应Ⅰ生成的气体为CO2,得到的沉淀是SnO。该沉淀经过滤后需漂洗,如何证明沉淀已经洗涤完全? 。
(4)多步操作包含的具体实验步骤的名称可以是: 。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 。
(6)该小组通过下列方法测所用锡粉样品的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl→SnCl2 + H2↑;
②加入过量的FeCl3 ;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:6FeCl2 + K2Cr2O7 + 14HCl →6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1. 226 g 锡粉样品,经上述各步反应后,共用去0.1000 mol/L K2Cr2O7溶液32.00 mL。则该锡粉样品中锡的质量分数是
查看答案和解析>>
科目: 来源:2013-2014学年上海市闸北区高三上学期期末考试化学试卷(解析版) 题型:推断题
丁子香酚存在于丁香油、樟脑油等中,常用于配制康乃馨型香精以及制异丁香酚和香兰素等,也用作杀虫剂和防腐剂。丁子香酚结构简式如图:
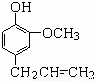
(1)丁子香酚的分子式为
(2)下列物质不能跟丁子香酚反应的是
A.NaOH溶液 B.NaHCO3溶液 C.Na2CO3溶液 D.溴水
(3)_____种,请写出其中任意两种的结构简式。
①与NaHCO3溶液反应 ② 苯环上只有两个取代基 ③ 苯环上的一氯取代物只有两种__________________、_________________。
(4)结合相关信息,请写出以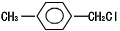 和乙醇为原料制备丁子香酚的一种同分异构体:对-甲基苯甲酸乙酯的合成路线(无机试剂任选)。
和乙醇为原料制备丁子香酚的一种同分异构体:对-甲基苯甲酸乙酯的合成路线(无机试剂任选)。
(合成路线常用的表示方式为:A B……
B…… 目标产物)
目标产物)
查看答案和解析>>
科目: 来源:2013-2014学年上海市闸北区高三上学期期末考试化学试卷(解析版) 题型:推断题
以烯烃为原料,合成某些高聚物的路线如下:
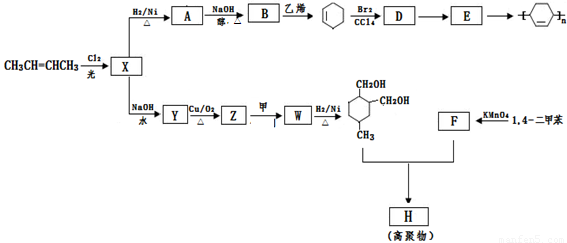
已知:
Ⅰ.
Ⅱ.甲为烃
Ⅲ.F能与NaHCO3反应产生CO2
请完成以下问题:
(1)CH3CH=CHCH3的名称是 , X中官能团的名称是 。
(2)D→E的反应类型为: 。
(3)写出下列化学方程式:
A→B ; E →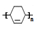 ;Z→W
。
;Z→W
。
(4)高聚物H的结构简式是 。
查看答案和解析>>
科目: 来源:2013-2014学年上海市闸北区高三上学期期末考试化学试卷(解析版) 题型:填空题
硫铁矿又称黄铁矿(主要成分FeS2,杂质不含硫元素),是地壳中分布最广的硫化物。因其浅黄的颜色和明亮的金属光泽,常被误认为是黄金,故又称“愚人金”。
工业上硫铁矿主要用于接触法制造硫酸,其反应原理为:
①FeS2与O2高温下反应生成SO2;
②SO2在催化剂作用下与O2反应生成SO3;
③SO3与H2O反应生成H2SO4.
(1)若1.00吨 SO2与O2的混合气体中含SO2 0.40吨,在一定条件下发生反应②,有80%的SO2发生转化,则反应后混合气体中SO3的质量分数是_________。
(2)现用80吨硫铁矿制硫酸,最后生产出100吨98%的硫酸。若反应过程中硫元素的损失率为5%,则硫铁矿中FeS2的质量分数为__________________。
(3)在浓硫酸中继续溶解SO3后所形成的液体称发烟硫酸,其浓度通常以游离的SO3含量来表示,如20%的发烟硫酸即表示在硫酸中含有20%的SO3。现有1L含SO330%的发烟硫酸(密度为1.95g/cm3),要把它稀释成质量分数为95%的浓硫酸,需加水约多少?(写出计算过程)
(4)已知:850℃~900℃时,硫铁矿在氧气中煅烧,可能发生下列反应:
①3FeS2+8O2→Fe3O4+6SO2
②4FeS2+11O2→2Fe2O3+8SO2
为使FeS2煅烧完全生成Fe2O3,工业上使用过量氧气,当氧气过量20%时,求所得炉气中SO2的体积分数。(写出计算过程)
57.将480 g纯净的FeS2在氧气中完全反应,若所得固体中n(Fe)∶n(O)=4∶a,此时消耗氧气b mol,试写出b与a的关系式_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com