
科目: 来源:2015届浙江省温州市十校联合体高一上学期期末联考化学试卷(解析版) 题型:选择题
在下列用途或反应中,硫酸表现出的性质为:
(A)高沸点性;(B)酸性;(C)吸水性;(D)脱水性;(E)强氧化性。试用字母填空:
(1)实验室制取氢气:___________; (2)浓硫酸可用钢瓶贮运:___________;
(3)将浓硫酸加到浓盐酸中产生白雾:__________;
(4)浓硫酸可使湿润的蓝色石蕊试纸先变红,后变黑:______________。
查看答案和解析>>
科目: 来源:2015届浙江省温州市十校联合体高一上学期期末联考化学试卷(解析版) 题型:实验题
为了证实木炭和浓H2SO4的反应产物,可用下列流程进行验证(箭头表示气体的流向)。

回答下列问题:
根据上述流程中什么现象证明产物是H2O、CO2、SO2:
; ; 。
(2)酸性KMnO4溶液的作用是 ,能否用溴水代替酸性高锰酸钾溶液? 。(填“能”或“不能”),请写出化学反应方程式 (若回答不能,则此空不用答题)
查看答案和解析>>
科目: 来源:2015届浙江省温州市十校联合体高一上学期期末联考化学试卷(解析版) 题型:选择题
关注饮用水,保证人民的生活质量。回答下列两个问题:
(1)饮用水中的NO3- 对人类健康会产生危害,为了降低饮用水中NO3-的浓度,可以在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
①上述反应中的氧化剂为 。
②上述反应中若生成标况下3.36LN2,则转移的电子数为 。
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上制取氯气的化学反应方程式为 。
②漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,反应的离子方程式为 。
查看答案和解析>>
科目: 来源:2015届浙江省温州市十校联合体高一上学期期末联考化学试卷(解析版) 题型:填空题
铝土矿(主要成分为Al2O3,还有少量杂质)是提取氧化铝的原料。提取氧化铝的工艺流程如下:
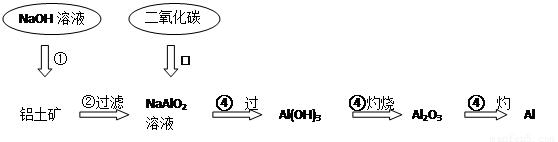
(1)请用离子方程式表示以上工艺流程中第①步反应:_______ _______。
(2)写出以上工艺流程中第③步反应的化学方程式:______ ___________。
(3)金属铝与氧化铁混合在高温下,会发生剧烈的反应。该反应的化学方程式_____________。请举一例该反应的用途________________。
(4)电解熔融氧化铝制取金属铝,若有0.9mol电子发生转移.理论上能得到金属铝的质量是________________。
查看答案和解析>>
科目: 来源:2015届浙江省温州市十校联合体高一上学期期末联考化学试卷(解析版) 题型:填空题
甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答。
(1)甲组同学采用如图所示装置验证铜与硝酸的反应。已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有3.2 g铜。

①请写出铜与稀硝酸反应的离子反应方程式 。
②在铜与硝酸的反应中,硝酸所表现出的化学性质主要有 。
③仪器c中收集的气体主要是 。(填分子式)
④待试管b中反应进行完全,如果向b中液体里加入足量氢氧化钠溶液,可生成沉淀的质量是 g。
(2)乙组同学对铁与稀硝酸的反应进行探究。他们用a mol Fe和含有b mol HNO3的稀硝酸进行实验,若两种物质恰好反应都无剩余,且HNO3只被还原成NO,反应结束后溶液中含有Fe3+和Fe2+。则
①反应结束后的溶液中NO3-的物质的量的取值范围是 。(用含a的代数式等表示)
②若反应结束后的溶液中Fe3+、Fe2+的物质的量之比n(Fe3+)∶n(Fe2+) 为3∶1,则b/a的值为 。
查看答案和解析>>
科目: 来源:2015届浙江省温州市十校联合体高一上学期期末联考化学试卷(解析版) 题型:计算题
有一硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀;滤液与4.0mol·L-1NaOH溶液反应,用去35mL碱液时恰好完全中和。试求:混合液中H2SO4、HNO3的物质的量浓度各是多少?
查看答案和解析>>
科目: 来源:2015届浙江省温州市十校联合体高一下学期期末联考化学试卷(解析版) 题型:选择题
下列行为不符合“促进低碳经济”宗旨的是( )
A.尽量使用含12C的产品,减少使用含13C或14C的产品
B.发展水电,开发新能源,如核能、太阳能、风能等,减少对矿物能源的依赖
C.推广煤的干馏、气化、液化技术,提供清洁、高效燃料和基础化工原料
D.推广利用微生物发酵技术,将植物桔杆、动物粪便等制成沼气以替代液化石油气
查看答案和解析>>
科目: 来源:2015届浙江省温州市十校联合体高一下学期期末联考化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是( )
A.四氯化碳分子比例模型:
B.次氯酸的结构式为 H-Cl-O
C.COS的电子式是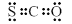
D.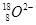 离子结构示意图:
离子结构示意图: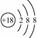
查看答案和解析>>
科目: 来源:2015届浙江省温州市十校联合体高一下学期期末联考化学试卷(解析版) 题型:选择题
下列各分子中,所有原子都满足最外层为8电子结构的是( )
A.H2O B.BF3 C.CCl4 D.PCl5
查看答案和解析>>
科目: 来源:2015届浙江省温州市十校联合体高一下学期期末联考化学试卷(解析版) 题型:选择题
下列各组物质的晶体中,化学键类型相同、晶体类型都相同的是( )
A.CO2和SiO2 B.C60和C(金刚石) C.NaCl和HCl D.CO2和H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com