
科目: 来源: 题型:解答题
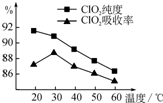 某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液.在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成
某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液.在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成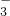 氧化成SO
氧化成SO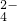 ,请写出制备二氧化氯(ClO2)的离子方程式:______.
,请写出制备二氧化氯(ClO2)的离子方程式:______.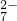 +6Fe2+═2Cr3++6Fe3++7H2O
+6Fe2+═2Cr3++6Fe3++7H2O查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题



查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
 Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的
Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的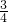 倍.A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物.回答下列问题:
倍.A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物.回答下列问题:查看答案和解析>>
科目: 来源: 题型:单选题
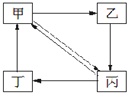 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是| 编号 | 甲 | 乙 | 丙 | 丁 |
| ① | Cu | CuO | CuSO4 | Cu(NO3)2 |
| ② | Na2CO3 | NaOH | NaHCO3 | CO2 |
| ③ | N2 | NH3 | NO | NO2 |
| ④ | CH3CH2Br | C2H5OH | CH2=CH2 | CH3CH3 |
查看答案和解析>>
科目: 来源: 题型:解答题
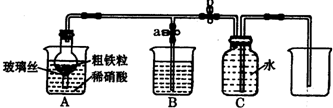
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液 | ______ |
| 第二步 | ______ | 若溶液紫色褪去,则说明含有Fe2+,若无明显变化,则说明不含Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com