
科目: 来源:2014届江苏省盐城市高三上学期期中考试化学试卷(解析版) 题型:填空题
过氧乙酸是一种弱酸性氧化剂,广泛用作漂白剂和高效杀菌消毒剂等。
Ⅰ、制备:冰醋酸与H2O2浓溶液按体积比1:1混合,加入适量浓硫酸,控制温度5℃~30℃,搅拌30min并静置4~6h。
反应原理为:H2O2+CH3COOH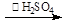
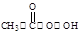 (过氧乙酸)+H2O
(过氧乙酸)+H2O
Ⅱ、含量测定:称取5.0000g过氧乙酸试样(液体),稀释至100mL备用。取上述稀释后过氧乙酸试样5.00mL,用0.0100 mol·L-1KMnO4溶液滴定到终点以除去其中的H2O2,随即加入10%KI溶液10mL,加入0.5%淀粉溶液3滴,摇匀,并用0.0500 mol·L-1Na2S2O3标准溶液滴定到蓝色刚好褪去(离子反应方程式为:I2+2S2O32-=2I-+S4O62-),消耗Na2S2O3标准溶液的总体积为20.00mL。
(1)制备过氧乙酸时,温度不宜过高,其原因可能是 。
(2)稀释样品时,除用到容量瓶及烧杯外,还用到的玻璃仪器有 、 。
(3)过氧乙酸溶液与KI反应的离子方程式为 。
(4)通过计算确定原试样中过氧乙酸的质量分数(写出计算过程)。 。
查看答案和解析>>
科目: 来源:2014届江苏省盐城市高三上学期期中考试化学试卷(解析版) 题型:填空题
铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
Zn2++2Fe2++3C2O42-+6H2O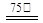 ZnFe2(C2O4)3·6H2O↓……………(a)
ZnFe2(C2O4)3·6H2O↓……………(a)
ZnFe2(C2O4)3·6H2O
 ZnFe2O4+2CO2↑+4CO↑+6H2O
……………(b)
ZnFe2O4+2CO2↑+4CO↑+6H2O
……………(b)
(1)上述制备原理中属于氧化还原反应的是 (选填:“a”或“b”)。
(2)制备ZnFe2(C2O4)3·6H2O时,可选用的药品有:
Ⅰ、(NH4)2Fe(SO4)2·6H2O,Ⅱ、ZnSO4·7H2O及Ⅲ、(NH4)2C2O4·7H2O。
①称量药品时,必须严格控制n(Fe2+)/n(Zn2+)= 。
②选用的加料方式是 (填字母)。
a.按一定计量比,Ⅰ、Ⅱ、Ⅲ同时加入反应器并加水搅拌,然后升温至75℃。
b.按一定计量比,Ⅰ、Ⅲ同时加入反应器加水配成溶液,然后加入Ⅱ,然后升温到75℃。
c.按一定计量比,将Ⅰ、Ⅱ混合并配成溶液甲,Ⅲ另配成配制溶液乙,甲、乙同时加热到75℃,然后将乙溶液缓慢加入甲溶液中,并持续搅拌。
(3)从溶液中分离出ZnFe2(C2O4)3·6H2O需过滤、洗涤。已洗涤完全的依据是 。
(4)ZnFe2(C2O4)3·6H2O热分解需用酒精喷灯,还用到的硅酸盐质仪器有 和 。
(5)某化学课外小组拟用废旧干电池锌皮(含杂质铁),结合下图信息利用实验可提供的试剂制取纯净的ZnSO4溶液。
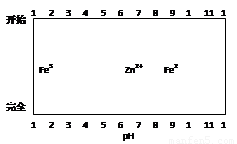
实验中可选用的试剂如下:
(a)30%H2O2;(b)新制氯水;
(c)1.0 mol·L-1NaOH溶液;
(d)3mol·L-1稀硫酸;
(e)纯ZnO粉末;
(f)纯锌粉。
实验步骤依次为:①将锌片完全溶于稍过量的3mol·L-1稀硫酸,加入 (选填字母,下同);②加入 ;③加热到60℃左右并不断搅拌;
④过滤得ZnSO4溶液。其中步骤③加热的主要目的有 。
查看答案和解析>>
科目: 来源:2014届江苏省盐城市高三上学期期中考试化学试卷(解析版) 题型:填空题
铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s)+3O2 (g)=2Cu2O(s)+2SO2(g) △H=-768.2kJ·mol-1,
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) △H=+116.0kJ·mol-1,
①热化学方程式:Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H= kJ·mol-1。
②获得的粗铜需电解精炼,精炼时粗铜作 极(选填:“阳”或“阴”)。
(2)氢化亚铜是一种红色固体,可由下列反应制备4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4。
①该反应还原剂是 (写化学式)。
②该反应每转移3mol电子,生成CuH的物质的量为 。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图所示。

①当c(Cl-)=9mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)=1mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
查看答案和解析>>
科目: 来源:2014届江苏省盐城市高三上学期期中考试化学试卷(解析版) 题型:填空题
具有光、电、磁等特殊功能的新型材料是目前化学研究的热点之一,二硫醇烯与锌的配合物(C)的一种合成途径如下。

(1)锌原子基态时核外电子排布式为 。
(2)下列说法正确的是 (不定项选择)。
a.金属钠的熔点比金属锂高
b.金属钠晶体属于面心立方堆积
c.CS2的沸点比CO2高
d.硫化钠晶胞(如图所示)中含4个S2-离子

(3)化合物B中CS32-的空间构型是 (用文字描述)
(4)配合物C中Zn2+的配位数是 (填数字),N原子杂化方式是 。
(5)1mol化合物A中含有σ键的数目为 。
查看答案和解析>>
科目: 来源:2014届江西省景德镇市高三一检化学试卷(解析版) 题型:选择题
下列有关化学用语或名称表达正确的是
A.Mg的原子结构示意图: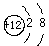
B.乙炔的分子结构模型示意图: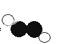
C.H2O2的电子式: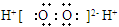
D.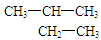 的名称:2-甲基丁烷
的名称:2-甲基丁烷
查看答案和解析>>
科目: 来源:2014届江西省景德镇市高三一检化学试卷(解析版) 题型:选择题
某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②沼气和水蒸气都是可再生能源;③冰和干冰既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦豆浆和雾都是胶体。上述说法正确的是
A.①③④⑦ B.①②⑤⑥ C.③⑤⑥⑦ D.①②③④
查看答案和解析>>
科目: 来源:2014届江西省景德镇市高三一检化学试卷(解析版) 题型:选择题
用NA表示阿伏伽德罗常数,下列说法正确的是
A.反应KClO3+6HCl=KCl+3Cl2↑+ 3H2O中,每生成1molCl2转移的电子为2NA
B.1molC8H18分子中含有的共用电子对数为26NA
C.在0℃,101kPa,1molSO3中含有NA个硫原子
D.0.5L0.1mol/LNH4Cl溶液中含NH4+离子的数目为0.05NA
查看答案和解析>>
科目: 来源:2014届江西省景德镇市高三一检化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.在Fe(OH)3胶体中加入HI溶液:Fe(OH)3 +3H+=Fe3+ +3H2O
B.在稀氨水中通入少量SO2:NH3•H2O+SO2=NH4++HSO3-
C.向澄清石灰水中加入足量NaHCO3溶液: Ca2+ +OH-+HCO3-=CaCO3↓+ H2O
D.在酸性KMnO4溶液中加入H2O2: 2MnO4-+5H2O2 +6H+=2Mn2++5O2↑+ 8H2O
查看答案和解析>>
科目: 来源:2014届江西省景德镇市高三一检化学试卷(解析版) 题型:选择题
室温下,强酸性和强碱性溶液中都不能共存的离子组是
A.Ba2+、Fe2+、NO3-、I- B.K+、Na+、SO32-、S2-
C.K+、Na+、AlO 2-、SO42- D.NH4+、Cu2+、Cl-、NO3-
查看答案和解析>>
科目: 来源:2014届江西省景德镇市高三一检化学试卷(解析版) 题型:选择题
下列顺序不正确的是
A.热稳定性:HF>HCl>HBr>HI
B.微粒的半径:Cl->Na+>Mg2+>Al3+
C.电离程度(同温度同浓度溶液中):HCl>CH3COOH>NaHCO3
D.分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com