
科目: 来源:2014届江苏省扬州市高三上学期10月月考化学试卷(解析版) 题型:填空题
黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]不溶于水和稀硫酸,制取黄钾铵铁矾的示意图如下:

(1)溶液X是________。
(2)检验滤液中是否存在K+的操作是________________________。
(3)黄钾铵铁矾的化学式可通过下列实验测定:
①称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。
③量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体224 mL,同时有红褐色沉淀生成。
④将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g。
通过计算确定黄钾铵铁矾的化学式(写出计算过程)。
查看答案和解析>>
科目: 来源:2014届江苏省扬州市高三上学期10月月考化学试卷(解析版) 题型:填空题
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:

⑴写出浸取过程中Cu2S溶解的离子方程式:____________________。
⑵回收S过程中温度控制在50~60℃之间,不宜过高或过低的原因是_____________。
⑶气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为___________________________;向滤液M中加入(或通入)下列__________(填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
⑷保温除铁过程中,加入CuO的目的是________________________;蒸发浓缩时,要用HNO3溶液调节溶液的pH,其理由是___________________________。
查看答案和解析>>
科目: 来源:2014届江苏省扬州市高三上学期10月月考化学试卷(解析版) 题型:实验题
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。现利用图10所示装置进行实验。

(1)装置③的作用是____________________。
⑵装置②中产生ClO2的化学方程式为____;
装置④中制备NaClO2的化学方程式为____。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55 ℃蒸发结晶;②趁热过滤;③____________;④低于60 ℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。
⑷达到滴定终点时的现象为________________。
⑸该样品中NaClO2的质量分数为____________(用含m、c、V的代数式表示)。
⑹在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为________________。
查看答案和解析>>
科目: 来源:2014届江苏省扬州市高三上学期10月月考化学试卷(解析版) 题型:填空题
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
⑴一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________(填字母)。
a.体系压强保持不变 b.混合气体颜色保持不变
c.体系中SO3的体积分数保持不变 d.每消耗1 mol SO2的同时生成1 mol NO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=________。
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为________(写出一种即可)。
⑶右图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。A为电池的________(填“正”或“负”)极,写出B极电极反应式:________________________。
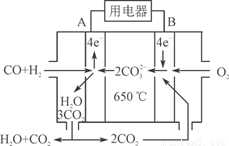
⑷工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应。
NO+NO2+Na2CO3=2NaNO2+CO2
2NO2+Na2CO3=NaNO2+NaNO3+CO2
①用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则混合气体中NO和NO2的体积比为
____________。
②用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是____________。
查看答案和解析>>
科目: 来源:2014届江苏省扬州市高三上学期10月月考化学试卷(解析版) 题型:填空题
从原子、分子水平上帮助我们认识物质构成的规律;以微粒之间不同的作用力为线索,研究不同类型物质的有关性质;从物质结构决定性质的视角预测物质的有关性质.

(1)下列说法正确的是 (填字母).
A.元素电负性由大到小的顺序为F>O>N
B.一个苯分子含3个π键和6个σ键
C.氯化钠和氯化铯晶体中氯离子的配位数相同
D.第一电离能的大小为Br>Se>As
(2)根据等电子体原理,羰基硫(OCS)分子的结构式为 .光气(COCl2)各原子最外层都满足8电子稳定结构,COCl2分子空间构型为 (用文字描述).
(3)Cu 2+基态的电子排布式为 .向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4晶体,该物质中配位原子的杂化方式为 ,不考虑空间构型,其内界结构可用示意图表示为 .
查看答案和解析>>
科目: 来源:2014届江苏省扬州市高二上学期期末检测化学(选修)试卷(解析版) 题型:选择题
下列做法与社会可持续发展理念相违背的是
A.将作物秸秆通过化学反应转化为乙醇用作汽车燃料
B.使用资源节约型、环境友好型的生物降解塑料包装袋
C.大力研发新型有机溶剂替代水作为萃取剂
D.利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用
查看答案和解析>>
科目: 来源:2014届江苏省扬州市高二上学期期末检测化学(选修)试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.甲醛的电子式: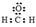
B.对甲基苯酚的结构简式: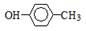
C.3,3-二甲基-1-戊烯的键线式: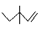
D.乙醇分子的比例模型: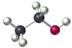
查看答案和解析>>
科目: 来源:2014届江苏省扬州市高二上学期期末检测化学(选修)试卷(解析版) 题型:选择题
下列有机物命名正确的是
A.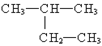 :2-甲基丁烷
:2-甲基丁烷
B.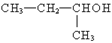 :2-甲基-1-丙醇
:2-甲基-1-丙醇
C.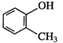 :甲基苯酚
:甲基苯酚
D.CH2=CH-CH=CH2:1,3-二丁烯
查看答案和解析>>
科目: 来源:2014届江苏省扬州市高二上学期期末检测化学(选修)试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,2.24 L CHCl3的原子总数为0.1 NA
B.4.2 g C3H6中含有的碳碳双键数一定为0.1 NA
C.1 mol —OH中电子数为10 NA
D.常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NA
查看答案和解析>>
科目: 来源:2014届江苏省扬州市高二上学期期末检测化学(选修)试卷(解析版) 题型:选择题
下列有关化学反应能量变化的叙述一定正确的是
A.生成物总能量大于反应物总能量,该反应为放热反应
B.一个化学反应需要加热才能进行,该反应为吸热反应
C.应用盖斯定律,可计算某些难以直接测量的化学反应焓变
D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件的∆H不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com