
科目: 来源:2014届江苏省高三上学期第一次月考化学试卷(解析版) 题型:选择题
用图中所示的装置进行实验,实验现象与预测不一致的是

①中的物质 ②中的物质 预测现象
A 浓氨水 FeCl3溶液 ②中有红褐色沉淀
B 浓氨水 浓盐酸 ③中有白烟
C 浓硝酸 淀粉KI溶液 ②中溶液变为蓝色
D 饱和亚硫酸 蓝色石蕊试液 ②中溶液先变红色又褪色
查看答案和解析>>
科目: 来源:2014届江苏省高三上学期第一次月考化学试卷(解析版) 题型:选择题
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中属于这种情况的是
①过量的锌与18mol/L的硫酸反应; ②过量的氢气与少量氮气在催化剂存在下充分反应;
③浓盐酸与过量的MnO2; ④过量铜与浓硫酸;
⑤过量稀硝酸与银反应; ⑥过量稀硫酸与块状石灰石
A.②③④⑥ B.②③⑤ C.①④⑤ D.①②③④⑤⑥
查看答案和解析>>
科目: 来源:2014届江苏省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列因果关系叙述正确的是
A.SO2具有漂白性,故可使酸性KMnO4溶液褪色
B.浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色
C.Na的金属性比Mg强,故可用Na与MgCl2溶液反应制取Mg
D.Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中Fe也显+3价
查看答案和解析>>
科目: 来源:2014届江苏省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论正确的是:
选项 实验操作 实验现象 结论
A 向溶液中滴加盐酸酸化的BaCl2溶液 产生白色沉淀 溶液中不一定含有SO42-
B 向溶液X中先滴加稀NaOH溶液,再将湿润红色石蕊试纸置于试管口附近 试纸不变蓝 原溶液中无NH4+
C 向PbO2中滴入浓盐酸 有黄绿色气体 PbO2具有氧化性
D 向溶液X中加入稀盐酸,并将产生的
无色气体通入澄清石灰水中 有白色沉淀生成 溶液X中一定含有CO32-
查看答案和解析>>
科目: 来源:2014届江苏省高三上学期第一次月考化学试卷(解析版) 题型:选择题
以色列科学家Daniel Shechtman因发现准晶体获得2011年诺贝尔化学奖。人们在自然界中也找到了组成为Al63Cu24Fe13的天然准晶体。将相同质量的此准晶体分别与足量的盐酸、烧碱和稀硝酸反应,产生气体的物质的量关系为
A.n(烧碱)<n(稀硝酸)<n(盐酸)
B.n(烧碱)<n(盐酸)<n(稀硝酸)
C.n(稀硝酸)<n(烧碱)<n(盐酸)
D.n(盐酸)<n(稀硝酸)<n(烧碱)
查看答案和解析>>
科目: 来源:2014届江苏省高三上学期第一次月考化学试卷(解析版) 题型:选择题
甲、 乙、 丙、 丁四种易溶于水的物质,分别由Na+、Ba2+、Al3+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成,已知:
①0.1 mol/L甲溶液中c(H+)>0.1 mol/L;
②将少量乙溶液分别滴入其他三种物质的溶液时,均有白色沉淀生成;
③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。 下列判断正确的是
A.甲溶液含有SO42- B.乙溶液含有SO42-
C.丙溶液显酸性 D.丁溶液显酸性
查看答案和解析>>
科目: 来源:2014届江苏省高三上学期第一次月考化学试卷(解析版) 题型:填空题
工业上生产高氯酸(沸点:90oC)时还同时生产了亚氯酸钠,其工艺流程如下:

(1)冷却过滤的目的是降低NaHSO4的 ,并分离出NaHSO4晶体。
(2)反应器2中发生反应的离子方程式为 ,SO2的
作用是作 剂。
(3)上述工业生产高氯酸的化学反应为:3NaClO3+3H2SO4(浓)=3NaHSO4+HClO4+2ClO2+H2O,氧化产物与还原产物的物质的量之比为 。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是高氯酸的沸点比较 (填“高”或“低”),容易从溶液中逸出,循环使用的物质是 。
查看答案和解析>>
科目: 来源:2014届江苏省高三上学期第一次月考化学试卷(解析版) 题型:实验题
氧化二氯是黄棕色具有强烈刺激性的气体。它的熔点-116℃,沸点3.8℃.氧化二氯不稳定,接触一般有机物易爆炸;它易溶于水(1∶100)同时反应生成次氯酸溶液。制取少量氧化二氯,是用干燥的氧化汞与氯气反应(还生成HgO·HgCl2)。装置如图,仅铁架台和夹持仪器已略去。
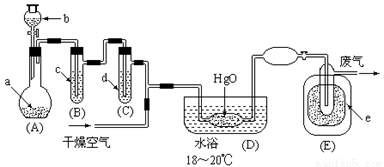
部分物质的有关物理数据如下:
|
化学式 |
熔点(单位:℃) |
沸点(单位:℃) |
|
N2 |
-209.86 |
-195.8 |
|
O2 |
-218.4 |
-183 |
|
CO2 |
-57 |
/ |
|
NH3 |
-77.3 |
-33.35 |
|
Cl2 |
-101 |
-34.6 |
试回答:
(1)A中深色固体与无色液体制备气体的离子方程式: 。
(2)B中盛有液体c是饱和 ,C中的液体d是浓硫酸。?
(3)氧化二氯制备出之后,要冷却为固态才便于操作和贮存,则E中的保温瓶中盛有致冷剂,它应是
(在干冰、冰水、液态空气、液氨中选择)。在E的内管得到的Cl2O中可能含有的主要杂质是反应物中过量的 。
(4)装置D、E间的连接方式与A、B、C间的连接方式有明显的区别,这区别是D、E中无 管、塞,用这些不同的连接方式的主要理由是氧化二氯接触有机物而 。
查看答案和解析>>
科目: 来源:2014届江苏省高三上学期第一次月考化学试卷(解析版) 题型:实验题
为探索工业废料的再利用,某化学兴趣小组设计了如下左图实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
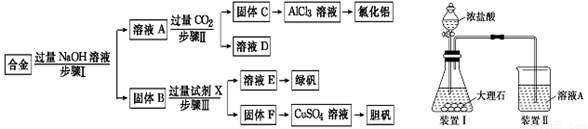
请回答:
(1)步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是 ,该操作中除用到烧杯和玻璃棒外,还必须用到的玻璃仪器有 。
(2)溶液A中的离子主要有Na+、OH-、 ;试剂X是 。
(3)进行步骤Ⅱ时,该小组用如上右图所示装置及试剂将制得的CO2气体通入溶液A中。一段时间后,
观察到烧杯中产生的白色沉淀逐渐减少,其原因是(用离子方程式表示) ;为了避免固体C减少,改进的措施是在装置Ⅰ、Ⅱ之间增加一个盛有饱和 溶液的洗气瓶。
(4)从溶液E中获得绿矾晶体的实验操作依次为(填操作名称) 、冷却结晶、过滤洗涤。
查看答案和解析>>
科目: 来源:2014届江苏省高三上学期第一次月考化学试卷(解析版) 题型:实验题
溴被称为“海洋元素”。已知Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。实验室模拟从海水中提取溴的主要步骤为:
步骤1:将海水蒸发浓缩除去粗盐
步骤2:将除去粗盐后的母液酸化后,通入适量的氯气,使Br-转化为Br2。
步骤3:向步骤2所得水溶液中通入热空气或水蒸气,将溴单质吹入盛有二氧化硫水溶液的容器中
步骤4:再向该容器中通入适量的氯气,使Br-转化为Br2
步骤5:用四氯化碳萃取溴单质,经分液、蒸馏得粗溴。
(1)步骤3中的反应的离子方程式 。
(2)步骤2中已经制得了溴,还要进行步骤3和步骤4的原因是 溴元素。
(3)步骤5中萃取和分液所需要的主要玻璃仪器为 。
(4)可用如图实验装置精制粗溴。
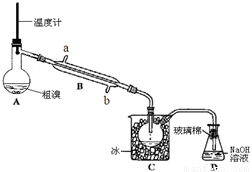
①图中冷却水应从B的 口进入(填“a”或“b”) 。
②C中加冰的目的是降温,减少溴的 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com