
科目: 来源:2014届山东省聊城市七校联考高二上学期期末检测化学试卷(解析版) 题型:选择题
利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
反应一:Ni(粗,s)+4CO(g)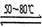 Ni(CO)4(g)
ΔH < 0
Ni(CO)4(g)
ΔH < 0
反应二:Ni(CO)4(g)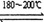 Ni(纯,s)+4CO(g) ΔH > 0
Ni(纯,s)+4CO(g) ΔH > 0
下列说法错误的是
A.对于反应一,适当增大压强,有利于Ni(CO)4的生成
B.提纯过程中,CO气体可循环使用
C.升高温度,反应一的反应速率减小,反应二的速率增大
D.对反应二,在180—200℃,温度越高,Ni(CO)4(g)的转化率越高
查看答案和解析>>
科目: 来源:2014届山东省聊城市七校联考高二上学期期末检测化学试卷(解析版) 题型:选择题
某学习小组为了探究 BrO3- +5Br- +6H+=3Br2 +3H2O 反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:zxxk
|
相关数据 |
① |
② |
③ |
④ |
⑤ |
|
c(H+)/ mol · L-1 |
0.008 |
0.008 |
0.004 |
0.008 |
0.004 |
|
c(BrO3-)/ mol· L-1 |
0.001 |
0.001 |
0.001 |
0.002 |
0.002 |
|
c(Br-)/ mol· L-1 |
0.10 |
0.20 |
0.20 |
0.10 |
0.40 |
|
v / mol· L-1· s-1 |
2.4×10-8 |
4.8×10-8 |
1.2×10-8 |
4.8×10-8 |
v1 |
下列结论不正确的是
A.若温度升高到40℃,则反应速率增大
B.实验②、④,探究的是c(BrO3-)对反应速率的影响
C.若该反应速率方程为v =k ca(BrO3-)cb(Br-)cc(H+)(k为常数),则c =2
D.实验⑤中,v1 =4.8×10-8 mol· L-1· s-1
查看答案和解析>>
科目: 来源:2014届山东省聊城市七校联考高二上学期期末检测化学试卷(解析版) 题型:选择题
下列生活中的现象,不涉及化学变化的是( )
A.用糯米酿酒 B.用干冰进行人工降雨
C.用过氧乙酸杀菌消毒 D.绿色植物的光合作用
查看答案和解析>>
科目: 来源:2014届山东省聊城市七校联考高二上学期期末检测化学试卷(解析版) 题型:选择题
下列实验操作或装置正确的是( )
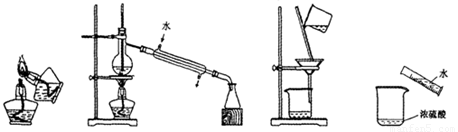
A.点燃酒精灯 B.蒸馏 C.过滤 D.稀释浓硫酸
查看答案和解析>>
科目: 来源:2014届山东省聊城市七校联考高二上学期期末检测化学试卷(解析版) 题型:选择题
下列化合物能够由单质直接化合得到的是( )
A.FeCl2 B.NO2 C. SO3 D.Na2O2
查看答案和解析>>
科目: 来源:2014届山东省聊城市七校联考高二上学期期末检测化学试卷(解析版) 题型:选择题
下列反应中不属于氧化还原反应的是( )
A.H2 +CuO  Cu + H2O
Cu + H2O
B.2Na + Cl2
 2NaCl
2NaCl
C.2H2O2
 2H2O + O2↑
2H2O + O2↑
D.Na2SO4 + BaCl2 =2NaCl +BaSO4↓
查看答案和解析>>
科目: 来源:2014届山东省聊城市七校联考高二上学期期末检测化学试卷(解析版) 题型:选择题
能用离子方程式H++OH-=H2O表示的化学反应是( )
A.氨水和稀盐酸反应 B.Ba(OH)2溶液和稀硫酸反应
C.KOH溶液和稀盐酸反应 D.KOH溶液和CO2反应
查看答案和解析>>
科目: 来源:2014届山东省聊城市七校联考高二上学期期末检测化学试卷(解析版) 题型:选择题
右图为原电池示意图,下列说法正确的是( )
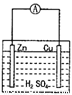
A.锌片是正极,铜片是负极
B.硫酸的浓度不变
C.该装置能够将电能转化为化学能
D.电子由锌片通过导线流向铜片
查看答案和解析>>
科目: 来源:2014届山东省聊城市七校联考高二上学期期末检测化学试卷(解析版) 题型:填空题
在一容积为2 L的密闭容器中,加入0.2
mol的N2和0.6
mol的H2,在一定条件下发生反应:N2(g)+3H2(g)  2NH3(g)
ΔH<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g)
ΔH<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
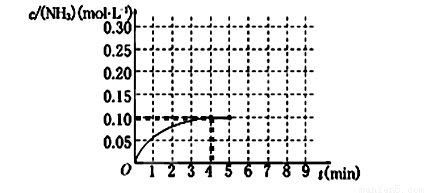
(1)根据上图,计算从反应开始到平衡时,氢气的平均反应速率v(H2)为______________。
(2)该反应达到平衡时N2的转化率_________________。
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为____________。(填序号)
a.0.20 mol·L-1 b.0.12 mol·L-1 c.0.10 mol·L-1 d.0.08 mol·L-1
(4)请写出该反应的平衡常数表达式_________,若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1 K2(填“>”、“=” 或 “<” )。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
查看答案和解析>>
科目: 来源:2014届山东省聊城市七校联考高二上学期期末检测化学试卷(解析版) 题型:填空题
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g) +2H2(g)  CH3OH(g)
ΔH
CH3OH(g)
ΔH
(1)判断反应达到平衡状态的依据是 (填序号)。
a. 生成CH3OH的速率与消耗CO的速率相等
b. 混合气体的密度不变
c. 混合气体的总物质的量不变
d. CH3OH、CO、H2的浓度都不再发生变化
(2)CO在不同温度下的平衡转化率与压强的关系如图1。
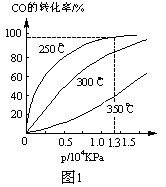
①该反应△H___0(填“>”或“<”)。
②实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是_______。
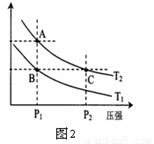
(3)右图2表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A____C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A_____C,由状态B到状态A,可采用______的方法(填“升温”或“降温”)。
(4)一定条件下,0.5mol甲醇蒸气完全燃烧生成二氧化碳气体和液态水,放出Q KJ的热量。写出该反应的热化学方程式 。
(5)图3是甲醇燃料电池(电解质溶液为KOH溶液)结构示意图,写出 a处电极上发生的电极反应式 。
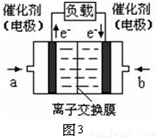
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com