
科目: 来源:2014届安徽六校教育研究会高三第一次联考化学试卷(解析版) 题型:选择题
有编号为A、B、C、D的四瓶无色液体,仅知道是1%酚酞、0.1mol·L-1NaOH溶液、0.1mol·L-1盐酸和0.1mol·L-1NaCl溶液。化学老师现要求甲、乙、丙、丁四位学生对它们进行鉴别,规定每人只需鉴别两瓶溶液,如果两瓶溶液鉴别都正确,得满分,如果只有一瓶鉴别正确,则算及格。以下是四位学生的鉴别结果:
A A为0.1mol·L -1盐酸 D为0.lmol·L-1NaCl溶液 老师评价:四位学生都及格,但是没有一个得满分
B A为0.1mol·L -1NaOH溶液 C为0.1mol·L-1盐酸
C A为1%酚酞 B为0.1mol·L-1盐酸
D D为0.1mol·L-1盐酸 B为0.1mol·L-1 NaOH溶液
下列结论正确的是
A.A为1%酚酞 B.B为0.1mol·L-1NaCl溶液
C.C为0.1mol·L-1NaOH溶液 D.D为0.1mol·L-1盐酸
查看答案和解析>>
科目: 来源:2014届安徽六校教育研究会高三第一次联考化学试卷(解析版) 题型:选择题
对含微量I-的某样品进行I-化学定量测定,有以下两种途径,最后均是以淀粉作指示剂,用Na2S2O3标准溶液滴定以求得I-的浓度。下列分析正确的是
已知:5I-+IO3-+6H+=3H2O+3I2 I-+3Br2(过量)+3H2O=6H++6Br-+IO3-
方法一I-(样品) IO3-
IO3-
 I2
I2
 I-
I-
方法二I-(样品) I2
I2 I-
I-
A.方法二对样品所做处理操作简便,用作微量的测定更准确
B.当待测液由无色变为蓝色时即达到滴定终点
C.方法一与方法二测量出的样品浓度比为6:l
D.假设各步骤操作均得当,方法一所消耗Na2S2O3标准溶液的体积是方法二的6倍
查看答案和解析>>
科目: 来源:2014届安徽六校教育研究会高三第一次联考化学试卷(解析版) 题型:选择题
杨老师在课堂上出示两瓶失去标签的Na2CO3和NaHCO3无色饱和溶液,希望班里同学提出简便的鉴别方法,该班同学踊跃提出看法,其中不合理的是
①用干燥的pH试纸检验,pH大的是Na2CO3
②取同量的溶液于两支试管中,各滴入酚酞试液,红色较深的是Na2CO3
③取同量的溶液于两支试管中,加热,有气泡产生的是NaHCO3
④取同量的溶液于两支试管中,逐滴加入稀盐酸,开始就有气体放出的是NaHCO3
⑤取同量的溶液于两支试管中,滴加BaCl2溶液,生成白色沉淀的是Na2CO3
⑥取同量的溶液于两支试管中,滴加Ba(OH)2溶液,生成白色沉淀的是Na2CO3
A.①② B.③⑥ C.④⑤ D.②⑤
查看答案和解析>>
科目: 来源:2014届安徽六校教育研究会高三第一次联考化学试卷(解析版) 题型:选择题
下图中a、b、c表示相应仪器中加入的试剂,可用下图装置制取、净化、收集的气体是

编号 气体 a b c
A NH3 浓氨水 生石灰 碱石灰
B CO2 盐酸 碳酸钙 饱和NaHCO3
C NO 稀硝酸 铜屑 H2O
D NO2 浓硝酸 铜屑 NaOH溶液
查看答案和解析>>
科目: 来源:2014届安徽六校教育研究会高三第一次联考化学试卷(解析版) 题型:选择题
等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2的物质的量之比为
A.3:4:1 B.3:3:2 C.6:7:3 D.6:9:0
查看答案和解析>>
科目: 来源:2014届安徽六校教育研究会高三第一次联考化学试卷(解析版) 题型:选择题
对溶液中的反应,如图图像中m表示生成沉淀的物质的量,n表示参加反应的某一种反应物的物质的量,则下列叙述中错误的是
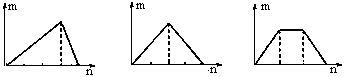
甲 乙 丙
A.符合甲图像的两种反应物可以是AlC13和NaOH
B.符合乙图像的两种反应物可以是Ca(OH)2和CO2
C.符合丙图像的反应可以是在Ca(OH)2和KOH的混合溶液中通入CO2
D.符合丙图像的反应可以是在NH4Al(SO4)2溶液中加入NaOH
查看答案和解析>>
科目: 来源:2014届安徽六校教育研究会高三第一次联考化学试卷(解析版) 题型:选择题
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法不正确的是

A.线段BC代表Fe3+物质的量的变化情况
B.原混合溶液中c(FeBr2)=6mol/L
C.当通入Cl22mol时,溶液中已发生的离子反应可表示为:
2Fe2++2I-+2C12=2Fe3++I2+4Cl-
D.原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3
查看答案和解析>>
科目: 来源:2014届安徽六校教育研究会高三第一次联考化学试卷(解析版) 题型:选择题
半导体工业用石英砂做原料通过三个重要反应生产单质硅
SiO2(s)+2C(s)=Si(s)+2CO(g) △H1=+682.44kJ·mol-1
(石英砂) (粗硅)
Si(s)+2C12(g)=SiCl4(l) △H2=一657.01kJ·mol-1
(粗硅)
SiCl4(l)+2Mg(s)=2MgCl2(s)+Si(s) △H3=一625.63kJ·mol-1
(纯硅)
若生产1.00kg纯硅放出的热量为
A.21.44kJ B.600.20kJ C.21435.71kJ D.1965.10kJ
查看答案和解析>>
科目: 来源:2014届安徽六校教育研究会高三第一次联考化学试卷(解析版) 题型:选择题
可逆反应aA(g)+bB(g) cC(g)+dD(s);△H=QkJ·mol-1,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、反应速率(v)与压强的关系如图所示。据图分析,以下说法正确的是
cC(g)+dD(s);△H=QkJ·mol-1,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、反应速率(v)与压强的关系如图所示。据图分析,以下说法正确的是

A.T1<T2,Q>0
B.增大压强,B的转化率减小
C.当反应达平衡时,混合气体的密度不再变化
D.a+b>c+d
查看答案和解析>>
科目: 来源:2014届安徽六校教育研究会高三第一次联考化学试卷(解析版) 题型:选择题
已知反应2CH3OH(g) CH3OCH3(g)+H2O(g)。某温度下的平衡常数为400。此温度下,在体积恒定的密闭容器中加入一定量的CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)。某温度下的平衡常数为400。此温度下,在体积恒定的密闭容器中加入一定量的CH3OH,反应到某时刻测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/mol·L-1 |
0.44 |
0.6 |
0.6 |
下列叙述中正确的是
A.该反应的平衡常数表达式为K=[c(CH3OCH3)×c(H2O)]/c(CH3OH)
B.此时正、逆反应速率的大小:υ正<υ逆
C.若经10min后反应达到平衡,此时c(CH3OH)=0.04mol/( L·min)
D.0~10min内平均反应速率υ(CH3OH)=1.6mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com