
科目: 来源:2012-2013学年天津市河西区高三总复习质量检测(二)理综化学试卷(解析版) 题型:选择题
下述实验能达到预期目的的是
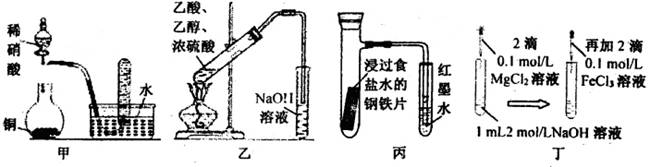
A.甲图:验证铜与稀硝酸反应的气体产物只有NO
B.乙图:实验室制取乙酸乙酯
C.丙图:验证钢铁片发生吸氧腐蚀
D.丁图:证明在相同温度下Mg(OH)2的溶解度大于Fe(OH)3
查看答案和解析>>
科目: 来源:2012-2013学年天津市河西区高三总复习质量检测(二)理综化学试卷(解析版) 题型:选择题
已知25℃时有关弱酸的电离平衡常数:
|
弱酸 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数 |
1.8×l0-5 |
4.9×l0-10 |
K1=4.3×l0-7 K2=5.6×l0-11 |
25℃下,下列有关说法正确的是
A.浓度为0.1mol/L的HCN溶液中c(OH-)=10-13mol/L
B.物质的量浓度相同的稀酸溶液中KW:CH3COOH>H2CO3>HCN
C.物质的量浓度相同的三种钠盐溶液的pH:NaHCO3>NaCN>CH3COONa
D.浓度均为amol•L-1HCN溶液与NaOH溶液等体积混合充分反应后的溶液中(忽略体积的变化)c(H+)<c(OH-)<c(CN-)<0.5amol/L
查看答案和解析>>
科目: 来源:2012-2013学年天津市河西区高三总复习质量检测(二)理综化学试卷(解析版) 题型:选择题
某恒容密闭容器中的反应X(g)+Y(g)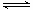 Z(g)
△H<0分两步进行:
Z(g)
△H<0分两步进行:
X(g)+Y(g)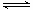 W(g)
△H>0和W(g)
W(g)
△H>0和W(g)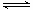 Z(g)
△H<0。下列图示有关该反应的信息不合理的是
Z(g)
△H<0。下列图示有关该反应的信息不合理的是
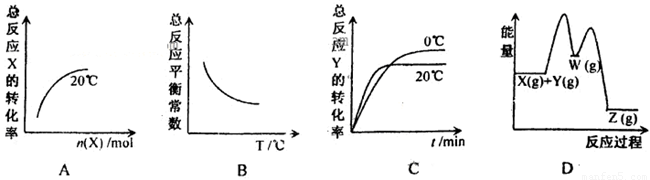
查看答案和解析>>
科目: 来源:2012-2013学年天津市河西区高三总复习质量检测(二)理综化学试卷(解析版) 题型:填空题
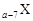 、
、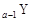 、
、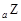 、
、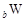 、
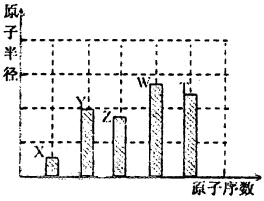
、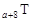 是五种常见的短周期元素,其原子半径随原子序数变化如下图所示。Z是地壳中含量最高的元素。W原子最外层电子数是K层电子数的2倍。
是五种常见的短周期元素,其原子半径随原子序数变化如下图所示。Z是地壳中含量最高的元素。W原子最外层电子数是K层电子数的2倍。
(l)W在周期表中的位置为_______________________。
(2)Y、Z的10电子氢化物分子中均含有的化学键类型为___________;其稳定性较强的是___________
(填化学式)。
(3)用化学方程式表示YZ2形成酸雨的反应:______________________。
用精密pH试纸(精确到0.l)测定酸雨pH的操作是______________________。
(4)常温下用1 mol/L100 mL NaOH溶液恰好完全吸收0.1molTZ2气体,此反应的离子方程式为
______________________;此时溶液pH<7的原因是___________________________。
(5)在25℃、101kPa下,己知W与X形成的气态化合物与足量Z2点燃完全反应(生成W的最高价
化合物),恢复至原状态,平均每转移l mol e_放热190 kJ,该反应的热化学方程式为___________。
查看答案和解析>>
科目: 来源:2012-2013学年天津市河西区高三总复习质量检测(二)理综化学试卷(解析版) 题型:填空题
某芳香族化合物A在一定条件下能发生如下图转化,部分产物已略去。气体F对
氢气的相对密度为22。

请按要求回答下列问题:
(1)E的分子式是_____________;B的结构式为_____________;C的含氧官能团有(写名称)
_____________;反应⑦的反应类型是_____________。
(2)设计反应①、⑥的目的是____________________________________________。
(3)写出下列反应的化学方程式:
反应④:_________________________________________________________________;
反应⑤:_________________________________________________________________。
(4)A的结构简式是_______________________________________。
(5)己知有机物H比C的分子少一个CH2,且H具有如下性质:①遇FeCl3溶液发生显色反应;②一
定条件下能发生水解反应;③分子中苯环上仅有两个相邻取代基。则H同分异构体的数目为_________;
其结构简式之一为____________________________________________________。
查看答案和解析>>
科目: 来源:2012-2013学年天津市河西区高三总复习质量检测(二)理综化学试卷(解析版) 题型:实验题
铁及其化合物在生产和生活中有着广泛的应用。某实验小组设计了如下实验探究
某些含铁化合物的制备、组成、性质等。请按要求回答下列问题:
(1)铁的氯化物的制备与组成:在实验室中,FeCl2可用________和盐酸反应制备,FeCl3可用铁粉和
________反应制备。现有一含有FeCl2和FeCl3的混合物样品,测得n(Fe)∶n(Cl)=1∶2.2,则该样
品中FeCl2和FeC13物质的量之比为__________。
(2)水处理剂和高容量电池材料――高铁酸钾(K2FeO4)的制备与应用:
FeC13与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
________________________________________________________________________;
与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,其正极电极反应式为
________________________________________________________________________。
(3)光敏材料三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)中铁元素含量的测定:
步骤一:称量10.00 g三草酸合铁酸钾晶体,配制成250 mL溶液。
步骤二:取所配溶液25.00
mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳。同时MnO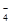 被还原成Mn2+。向反应后的溶液中加入适量锌粉,至黄色刚好消失,所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
被还原成Mn2+。向反应后的溶液中加入适量锌粉,至黄色刚好消失,所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤三:用0.0200
mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02 mL,滴定中MnO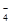 还原成Mn2+。
还原成Mn2+。
重复步骤二、三操作,步骤三消耗0.0200 mol/L KMnO4溶液19.98 mL。
①步骤一中除量筒、玻璃棒、烧杯外,还需要的玻璃仪器有____________________;步骤三滴定过程中盛装KMn4溶液的仪器名称为___________;滴入最后一滴溶液时,锥形瓶中溶液变为_________色,静置半分钟溶液颜色不再变化,确认为滴定终点。
②步骤二加入锌粉的目的是_______________________________;
写出锌参与反应的离子方程式:____________________________________________。
③实验测得该晶体中铁元素的质量分数为____________。在步骤二中,若加入的KMnO4溶液的量不足,则测得的铁元素含量____________。(填“偏低”“偏高”或“无影响”)
查看答案和解析>>
科目: 来源:2012-2013学年天津市河西区高三总复习质量检测(二)理综化学试卷(解析版) 题型:实验题
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟制备氨基甲酸铵,并探究其分解反应平衡常数。反应的化学方程式: 2NH3(g)+CO2(g)  NH2COONH4(s)。请按要求回答下列问题:
NH2COONH4(s)。请按要求回答下列问题:
(1)请在下图1方框内画出用浓氨水与生石灰制取氨气的装置简图。
(2)制备氨基甲酸铵的装置如下图2所示。生成的氨基甲酸铵小晶体悬浮在四氯化碳中。

①从反应后的混合物中分离出产品的实验方法是_____________(填操作名称)。
②上图3中浓硫酸的作用是_______________________________________。
(3)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积
忽略不计),在恒定温度下使其达到分解平衡。实验测得不同温度下的平衡数据列于下表:
|
温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
|
平衡气体总浓度(×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①下列选项可以判断该分解反应达到平衡的是________。
A.
B.密闭容器内物质总质量不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②该分解反应的焓变ΔH______0(填“>”、“=”或“<”)。
25.0℃时的分解平衡常数的值=__________________________。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量将_________(填“增加”,“减少”或“不变”)。
(4)图2中反应器用冰水冷却的原因是_____________________________________。
查看答案和解析>>
科目: 来源:2012-2013学年天津市红桥区高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
化学已经渗透到人类生活的各个方面,下列说法正确的是
A.垃圾焚烧不仅可以用于发电,还不会带来任何新污染
B.喂养鸡的过程中大量使用抗生素,大量进食这样的鸡肉对人体健康有益
C.油脂在人体内水解为氨基酸和甘油等小分子被吸收
D.铜具有良好的导电性,常用来制作印刷电路板
查看答案和解析>>
科目: 来源:2012-2013学年天津市红桥区高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.向H2O中投入少量Na218O2固体:2H2O+2Na218O2=4Na++418OH-+O2↑
B.Fe3O4与稀硝酸反应:Fe3O4+8H+=2Fe3++Fe2++4H2O
C.向含有0.4 mol FeBr2的溶液中通入0.5 mol Cl2充分反应:4Fe2++8Br-+5Cl2=4Fe3++10Cl-+4Br2
D.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O
查看答案和解析>>
科目: 来源:2012-2013学年天津市红桥区高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
下列装置或实验操作正确的是
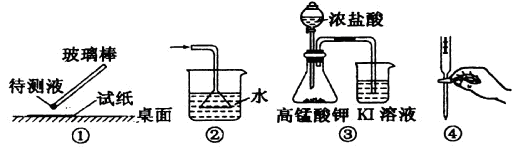
A.①用pH试纸测某溶液的酸碱性 B.②吸收氨气制氨水
C.③探究氧化性:KMnO4>Cl2>I2 D.④中和滴定实验
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com