
科目: 来源:2012-2013学年天津市河东区高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列操作错误的是
A.配制0.1mol·L-1的H2SO4溶液时,量取浓硫酸小心注入盛有少量蒸馏水的容量瓶中
B.若要除去CO2中含有的少量SO2气体,可通过盛有饱和NaHCO3溶液的洗气瓶
C.在实验室中使用金属钠时若不慎着火,可立即用细沙灭火
D.测溶液pH时,可用干净的玻璃棒蘸取溶液滴到放在表面皿上的pH试纸上
查看答案和解析>>
科目: 来源:2012-2013学年天津市河东区高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.常温下,将pH=11的氨水稀释到原体积的10倍后,溶液的pH=10
B.为确定某酸.H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1mol/L),至中性时,溶液中的酸未被完全中和
D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水②0.1 mol/L盐酸 ③0.1 mol/L氯化镁溶液④0.1 mol/L硝酸银溶液中,则Ag+浓度:①>④=②>③
查看答案和解析>>
科目: 来源:2012-2013学年天津市河东区高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
根据下图,下列判断中正确的是

A.烧杯a中的溶液H+增大
B.烧杯b中发生氧化反应
C.烧杯a中发生的反应为:2H+ +2e-=H2
D.烧杯b中发生的反应为:2Cl--2e-=Cl2
查看答案和解析>>
科目: 来源:2012-2013学年天津市河东区高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
在下图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,F在D中燃烧发出苍白色火焰。H可用于制造光导纤维,J是一种乳白色凝胶状沉淀。(部分生成物和部分反应条件未列出)
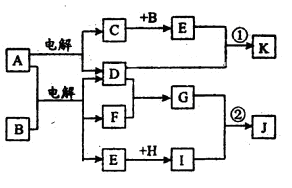
请回答下列问题:
(1)A的电子式为
形成单质D的元素在周期表中的位置
(2)形成C、D、F单质的元素半径由大到小的顺序(填写元素符号)
(3)C长期暴露在空气中,最终产物是
(4)H的化学式为 H在高温下与碳反应,若转移4mol电子参加反应的碳为 mol。
(5)写出反应①的离子方程式
(6)写出反应②的化学方程式
查看答案和解析>>
科目: 来源:2012-2013学年天津市河东区高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
I.已知有机物A仅含碳、氢、氧3种元素,质谱分析可知其相对分子质量为46,核磁共振氢谱显示分子中有三种不同化学环境的氢原子,且有如下的转化关系:
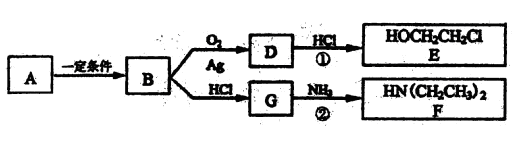
(1)由A→B的化学反应方程式是 ,反应类型是 反应。
(2)D的红外光谱表明分子内除C-H键、C-C键外还含有两个C—O单键,反应①中D与HCl按物质的量之比1:1反应,则D的结构简式是
由E制备乙二醇需要加入的试剂是
Ⅱ.化合物E和F是药品普鲁卡因合成的重要原科,普鲁卡因的合成路线如下(已知 ):
):
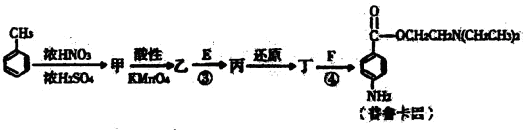
(4)乙的含氧官能团名称为 、
(5)丁的结构简式为
(6)反应③的化学方程式是
(7)普鲁卡因有两种水解产物戊和己,且戊与甲具有相同的分子式。写出任意3种符合下列条件的戊的同分异构体 (不包含戊);
a.分子结构中含苯环,且每个苯环有2个侧链
b.分子结构中一定含官能团—NH2且—NH2直接与碳原子相连
(8)戊经聚合反应制成的高分子纤维广泛用于通讯、宇航等领域。该聚合反应的化学方程式是 。
查看答案和解析>>
科目: 来源:2012-2013学年天津市河东区高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验I:制取NaClO2晶体
己知:NaClO2饱和溶液在温度低于38℃时析出品体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置进行实验。
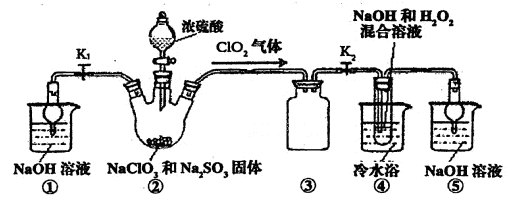
(1)装置③的作用是
装置①的作用是
(2)装置②中产生ClO2的还原剂是
装置④中制备ClO2的化学方程式为
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶:②趁热过滤;③ ;④低于60℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品小打烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)。将所得混合液配成250mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。
(4)达到滴定终点时的现象为
(5)该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
(6)在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为 。
查看答案和解析>>
科目: 来源:2012-2013学年天津市河东区高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
尿素(H2NCONH2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位。
(1)工业上合成尿素的反应如下:
2NH3(l)+CO2(g) H2O(l)+H2NCONH2(l)
△H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2(l)
△H=-103.7 kJ·mol-1
下列措施中有利于提高尿素的生成速率的是
A.采用高温
B.采用高压
C.寻找更高效的催化剂
D.减小体系内CO2浓度
(2)合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g)
 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1
第二步:H2NCOONH4(l)
 H2O(l)+H2NCONH2(l)
△H2.
H2O(l)+H2NCONH2(l)
△H2.
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和l mol二氧化碳,实验测得反应中各组分随时间的变化如下图I所示:
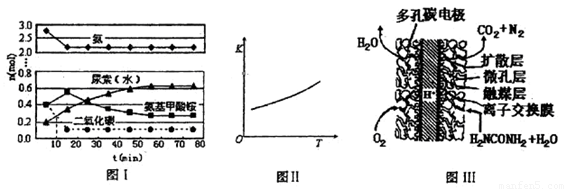
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定,总反应进行到 min时到达平衡。
②第二步反应的平衡常数K随温度的变化如上图II所示,则△H2 0(填“>” “<” 或 “=”)
(3)在温度70-95℃时,工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2
①尿素与NO、NO2三者等物质的量反应,化学方程式为
②已知:N2(g)+O2(g)=2NO(g).△H=180.6 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) △H=-92.4 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ·mol-1
则4NO(g)+4NH3(g)+O2(g)=4N2(g)+6H2O(g) △H= kJ·mol-1
(4)尿素燃料电池结构如上图III所示。其工作时负极电极反应式
可表示为 。
查看答案和解析>>
科目: 来源:2012-2013学年天津市河北区高三年级总复习质量检测二理综化学试卷(解析版) 题型:选择题
近期陆续曝光了一些制药企业为了谋求暴利,用经生石灰处理过的皮革废料,熬制成工业明胶,制成药用胶囊。下列说法错误的是
A.工业明胶是一种从动物的结缔或表皮组织中的胶原部分水解出来的蛋白质,其制备过程中因混有杂质,经常显现出鲜艳的颜色,因此可以将其作为食品添加剂中的着色剂使用
B.此次曝光出的毒胶囊中有大家熟悉的阿莫西林胶囊。阿莫西林是一种最常用的青霉素类广谱抗生素,病人在使用青霉素前一定要进行皮试
C.皮革在工业加工时,耍使用含铬的糕制剂,因此往往会造成铬含量的严重超标,重金属铬可使人体内的蛋白质变性
D.生石灰与水的反应产物俗称熟石灰,其在工业生产上有很多用途,如治理酸性废水、制取漂白粉等
查看答案和解析>>
科目: 来源:2012-2013学年天津市河北区高三年级总复习质量检测二理综化学试卷(解析版) 题型:选择题
下列事实不能用金属活动性解释的是
A.生活中可用铝制的水壶烧水
B.镀锌铁制品破损后,镀层仍能保护铁制品
C.工业上常用热还原法冶炼铁,用电解法冶炼钠
D.电解法精炼铜时,其含有的Ag、Au杂质沉积在电解槽的底部
查看答案和解析>>
科目: 来源:2012-2013学年天津市河北区高三年级总复习质量检测二理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.热稳定性:HI>HBr>HCl>HF
B.电离程度(同温度同浓度溶液中):HCl>CH3OOH>NaHCO3
C.分散质粒子的直径:FeCl3溶液>Fe(OH)3胶体>Fe(OH)3悬浊液
D.天然油脂的分子中含有酯基,属于酯类
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com