
科目: 来源:2012-2013学年上海市浦东新区高三下学期三模考试化学试卷(解析版) 题型:实验题
某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
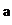
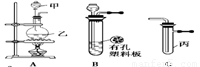
请按要求填空:
(1)利用B装置可制取的气体有 (填2种)。
A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。
若在丙中加入适量水,即可制得氯水。将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:
|
实验序号 |
实验操作 |
现象 |
结论 |
|
Ⅰ |
将氯水滴入品红溶液 |
溶液褪色 |
氯气与水反应的产物有漂白性 |
|
Ⅱ |
氯水中加入 NaHCO3粉末 |
有无色气泡产生 |
氯气与水反应的产物具有较强的酸性 |
(2)请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由。
。
(3)请利用上述A、C装置设计一个简单的实验,验证Cl2和Br2的氧化性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)
。
B、D、E装置相连后,在B中盛装足量浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。
(4)B中发生反应的化学方程式为 。
(5)欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹 ,再打开止水夹 ,使烧杯中的水进入试管丁的操作是
。
(6)试管丁中的NO2与一定量的O2混合后倒插水中,试管9/10充满水,则原试管丁中的混合气体的平均分子量可能为 。(保留二位小数)
查看答案和解析>>
科目: 来源:2012-2013学年上海市浦东新区高三下学期三模考试化学试卷(解析版) 题型:填空题
重晶石矿(主要成分为硫酸钡)因为含有Fe2O3、MnO及炭质等杂质而常呈深褐色。工业上将重晶石矿粉碎后与硫酸、铝粉在反应槽中混合加热(即“漂白”),再经水洗等一系列工序制得白色的重晶石填料,广泛用作纸张、油漆等的填充剂。已知MnO是碱性氧化物,Al粉可以将深色的Fe3+转化为浅色的Fe2+。
重晶石填料的生产工艺流程为:
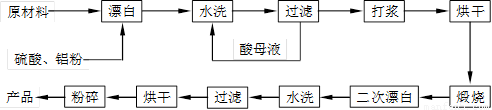
(1)在该流程中,为加快“漂白”速度,采取的措施有 、
。
(2)硫酸起到了“漂白”的作用。请写出硫酸直接起到该作用时的化学方程式:
、 。
(3)二次漂白水洗过滤后,检验滤渣不含Fe2+离子的方法是
、 。
(4)二次漂白前,煅烧的主要目的是 。将煅烧后的固体磨成细粉,使用的是加有刚玉球的振动磨。这说明刚玉具有很高的 。
(5)工业生产中为了充分利用资源,将滤液经过处理得到化工原料Fe2O3。操作过程是:
①滤液中通入过量Cl2,其目的是 。
②再加入适量NaOH来调节溶液的pH ,其目的是 ,调节溶液的pH范围为 。
有关离子开始沉淀及完全沉淀时的pH如下:
|
离子 |
开始沉淀时的pH |
完全沉淀时的pH |
|
Fe2+ |
7.6 |
9.7 |
|
Fe3+ |
2.7 |
3.7 |
|
Al3+ |
3.8 |
4.7 |
|
Mn2+ |
8.3 |
9.8 |
(6)最后通过 、 得到氧化铁。
查看答案和解析>>
科目: 来源:2012-2013学年上海市浦东新区高三下学期三模考试化学试卷(解析版) 题型:填空题
2004年诺贝尔化学奖授予阿龙·切哈诺沃等三位科学家,以表彰他们发现了泛素调节的蛋白质降解。化合物A是天然蛋白质水解的最终产物,其相对分子质量为165,其中O元素的质量分数小于20%,N元素的质量分数小于10%。
(1)化合物A的分子式为 ;光谱测定显示,化合物A分子结构中不存在甲基(—CH3),则化合物A的结构简式为 。写出A发生缩聚反应的方程式
。
(2)化合物B是A的同分异构体,是某芳香烃一硝化后的唯一产物(硝基连在芳环上)。则化合物B的结构简式是 。
写出制备TNT的化学方程式 。
查看答案和解析>>
科目: 来源:2012-2013学年上海市浦东新区高三下学期三模考试化学试卷(解析版) 题型:填空题
有机物A是一种军用催泪弹的主要有效成分。经分析A的相对分子质量为161,除含有C、H元素外,它还含有一种卤族元素,且分子中只含有一个甲基。化合物A~F的转化关系如下图所示,其中足量的新制Cu(OH)2悬浊液与1mol C反应可生成1mol Cu2O 和1mol D,B1和B2均为较稳定的化合物且互为同分异构体。
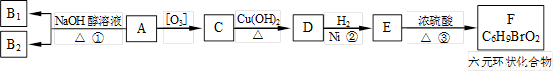
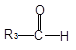
已知:①
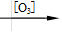
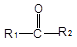 +
+
②一个碳原子上连有两个碳碳双键的结构(—C=C=C—)不稳定。
请完成下列问题;
(1)化合物A含有的官能团是 。B1的相对分子质量是 。
(2)①、②、③的反应类型分别是 。
(3)写出A、F的结构简式:
A. ;F. 。
(4)写出C→D反应的化学方程式:
。
(5)符合下列条件的C的同分异构体共有________种。
①含有二个甲基;②含有二个醛基。
查看答案和解析>>
科目: 来源:2012-2013学年上海市浦东新区高三下学期三模考试化学试卷(解析版) 题型:计算题
氨气是化学工业上应用非常广泛的物质。下面仅是它在两方面的重要用途。
“侯氏制碱法”的发明为振兴中国化工工业做出了重要贡献。制碱法的第一步反应是向饱和氨化盐水中通入二氧化碳,该反应可表示为:NaCl + CO2 + NH3 + H2O → NaHCO3↓+ NH4Cl
现在45℃时,取117g食盐配制成饱和溶液,向其中通入适量氨气后,再向其中通入二氧化碳,使反应进行完全。试计算并回答下列问题(计算结果取三位有效数字)(有关物质的溶解度数据如表,单位:g/100g水)。
|
|
NaCl |
NaHCO3 |
NH4Cl |
|
10℃ |
35.8 |
8.15 |
33.0 |
|
45℃ |
37.0 |
14.0 |
50.0 |
(1)117g食盐理论上可以制取纯碱 g;
(2)45℃反应完毕后,有晶体析出;溶液中剩余水 g,析出晶体的质量 g。
(3)过滤除去析出的晶体后再降温至10℃,又有晶体析出,计算所析出晶体的质量共 克
工业制硝酸也是氨气重要用途之一,反应如下:
4NH3+5O2→4NO+6H2O 2NO+O2→2NO2 3NO2+H2O→2HNO3+NO
将a mol的NH3与b mol的O2混合后,充入一密闭容器,在Pt存在下升温至700℃,充分反应后,冷却至室温。
 (4)请讨论b∕a的取值范围及与之对应的溶液的溶质及其物质的量,将结果填于下表中:
(4)请讨论b∕a的取值范围及与之对应的溶液的溶质及其物质的量,将结果填于下表中:
|
b∕a的取值范围 |
溶质 |
溶质物质的量 |
|
|
|
|
|
|
—— |
—— |
|
|
|
|
|
|
|
|
查看答案和解析>>
科目: 来源:2012-2013学年四川省成都市高三第一次诊断性考试理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是
A.0.1mol的2H35Cl含中子数为1.8NA
B.16g O3和O2混合物中氧原子数为NA
C.常温下,1L pH=l的溶液中H+的数目大于0.1NA
D.0.1 mol的H2O2中含有非极性键数为0.2NA
查看答案和解析>>
科目: 来源:2012-2013学年四川省成都市高三第一次诊断性考试理综化学试卷(解析版) 题型:选择题
从分类的角度研究右图所示实验,下列有关分析不正确是
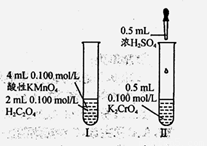
A.Cr和Mn均为副族d区元素
B.H2C2O4和H2SO4均为电解质
C.反应II为非氧化还原反应
D.I、II中随反应进行反应速率均逐渐减小
查看答案和解析>>
科目: 来源:2012-2013学年四川省成都市高三第一次诊断性考试理综化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.遇Fe(CN)63-显蓝色的溶液:Ca2+、 Cl- 、ClO- 、Fe3+
B.水电离出c(OH-)>10-5mol/L: Mg2+、 Cl- 、NO3- 、Na+;
C.遇石蕊变红的溶液:Na+、 NH4+ 、NO3- 、K+
D.与铝反应产生大量氢气的溶液:Ba2+、 HCO3- 、l- 、Fe2+
查看答案和解析>>
科目: 来源:2012-2013学年四川省成都市高三第一次诊断性考试理综化学试卷(解析版) 题型:选择题
从淡化海水中提取溴的流程如下:

下列有关说法不正确的是
A.X试剂可用Na2SO3饱和溶液
B.步骤Ⅲ的离子反应:2Br- + Cl2 = 2Cl- +Br2
C工业上每获得1 mol Br2,需要消耗Cl2 44.8 L
D.步骤IV包含萃取、分液和蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com