
科目: 来源:2014届河南省开封市高二上学期五县六校期末联考化学试卷(解析版) 题型:选择题
下列说法中正确的是:( )
A.绝对不溶解的物质是不存在的
B.不溶于水的物质溶解度为0
C.物质的溶解性为难溶,则该物质不溶于水
D.某离子被沉淀完全是指该离子在溶液中的浓度为0
查看答案和解析>>
科目: 来源:2014届河南省开封市高二上学期五县六校期末联考化学试卷(解析版) 题型:选择题
常温下,在体积都为0.1 L,pH都等于1的盐酸和醋酸溶液中,各投入0.65 g锌粒,则下图所示比较符合客观事实的是:( )

查看答案和解析>>
科目: 来源:2014届河南省开封市高二上学期五县六校期末联考化学试卷(解析版) 题型:选择题
用铂电极电解下列溶液时,在阳极上有气体放出,且溶液的PH下降的是( )
A.KNO3 溶液 B.HCl 溶液 C.NaOH 溶液 D.CuSO4 溶液
查看答案和解析>>
科目: 来源:2014届河南省开封市高二上学期五县六校期末联考化学试卷(解析版) 题型:填空题
(1)25 ℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g) 2NH3(g)
△H=-92.4 kJ/mol
2NH3(g)
△H=-92.4 kJ/mol
①在该温度时,取l mol N2和3 mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是_______92.4 kJ。(填“小于”, “大于” 或“等于”)
②一定条件下,上述可逆反应在体积固定的密闭容器中进行,下列叙述能说明反应已达到平衡的是_______________。
A.NH3生成的速率与NH3分解的速率相等
B.混合气体的反应速率 v正(NH3)=v逆(H2)
v正(NH3)=v逆(H2)
C.容器内的密度不再变化
D.单位时间内消耗a mol N2,同时生成2a mol NH3
(2) 25 ℃时,将工业生产中产生的NH3溶于水得0.1mol/L氨水20.0 mL,测得PH=11,则该条件下,NH3•H2O的电离平衡常数为__________。向此溶液中加入少量的氯化铵固体,此时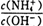 值将_____(填“增大”, “减小” 或“不变”)。
值将_____(填“增大”, “减小” 或“不变”)。
(3)常温下,向0.001mol/LAlCl3溶液中通入NH3直至过量,当PH=_________时,开始生成沉淀(已知:Ksp[Al(OH)3]=1.0×10-33)
查看答案和解析>>
科目: 来源:2014届河南省开封市高二上学期五县六校期末联考化学试卷(解析版) 题型:填空题
(1)已知2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ/mol,
CO(g)+1/2O2(g)=CO2(g)ΔH=-283.0 kJ/mol。某H2 和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6 g液态水,则原混合气体中H2和CO的物质的量之比为___________。
(2)以甲醇、空气,氢氧化钾溶液为原料,石墨为电极,可构成燃料电池;已知该燃料电池的总反应式是:2CH3OH +3O2+4OH-=2CO32-+6H2O,该燃料电池发生反应时,正极区溶液的PH__________ (填“增大”, “减小” 或“不变”)该电池的负极反应式为_________________。
(3) 用上述燃料电池进行粗铜的精炼,粗铜应连接电源的________极,该粗铜精炼电解池的阴极反应式为_________________。
查看答案和解析>>
科目: 来源:2014届河南省开封市高二上学期五县六校期末联考化学试卷(解析版) 题型:选择题
某同学用0.10 mol/L的HCl溶液测定未知浓度的NaOH溶液,其实验操作如下:
A.用酸式滴定管量取20.00mLHCl溶液注入锥形瓶,同时滴加2-3滴酚酞试液;
B.用0.10 mol/L的HCl溶液润洗酸式滴定管;
C.把滴定管用蒸馏水洗净;
D.取下碱式滴定管,用待测NaOH溶液润洗后,将待测NaOH溶液注入碱式滴定管至距离刻度“0”以上2—3cm处,再把碱式滴定管固定好,调节液面;
E.检查滴定管是否漏水;
F.另取锥形瓶,再重复以上操作1—2 次;
G.把锥形瓶放在碱式滴定管下边,瓶下垫一张白纸,边滴边摇动锥形瓶,直到加入最后一滴碱液后溶液颜色突变并在半分钟内不再变色为止,记下滴定管液面所在的刻度。请回答下列问题:
(1)滴定操作的正确顺序是:(填字母) →C→ →B→ → → 。
(2)G步操作中在锥形瓶下垫一张白纸的作用是 。
(3)D步操作中液面应调节到 ,尖嘴部分应 。
(4)滴定终点读数时,如果仰视液面,读出的数值 ,若滴定前平视读数则由此计算得到的NaOH溶液浓度 (填“偏大”、“偏小”、“无影响”)
(5)下图分别是量筒、滴定管、温度计的一部分,则量筒,滴定管,温度计分别是 ,

查看答案和解析>>
科目: 来源:2014届河南省开封市高二上学期五县六校期末联考化学试卷(解析版) 题型:填空题
如下图装置中,b电极用金属 M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡。试回答:

(1)a为 极,c极的电极反应式为 。
(2)电解进行一段时间后,罩在c极上的试管中也能收集到的气体,此时c极上的电极反应式为 。
(3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上放出了气体的物质的量为 ,若b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为 。
查看答案和解析>>
科目: 来源:2014届河南省开封市高二上学期五县六校期末联考化学试卷(解析版) 题型:填空题
工业制备氯化铜时,将浓盐酸用蒸气加热至80 ℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3]。请回答以下问题:
(1)第一步除去Fe2+,能否直接调整溶液pH=9.6,将Fe2+沉淀除去? ,(填“能” 或“不能”)理由是 ,
(2)有人用强氧化剂NaClO先将Fe2+氧化为Fe3+,再调整溶液的PH将Fe3+沉淀除去:
①加入NaClO后,溶液的pH变化是________(填代号)。
A.一定增大 B.一定减小 C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当? ,(填“是” 或“否”)现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有________(有几个选几个,填代号)。
A.浓HNO3 B.Cl2 C.KMnO4 D.H2O2
(3)加入适当物质调整溶液pH,使Fe3+转化为Fe(OH)3沉淀,可以达到除去Fe3+而不损失CuCl2的目的,则调整溶液pH可选用下列物质中的___________。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
查看答案和解析>>
科目: 来源:2014届浙江省温州市十校联合体高三上学期期初联考化学试卷(解析版) 题型:选择题
化学与生活、环境、材料和科技等密切相关,下列说法正确的是 ( )
A.SiO2制成的玻璃纤维,由于导电能力强而被用于制造通讯光缆
B.煤经过气化和液化等物理变化可以转化为清洁燃料
C.纤维素在人体内可水解为葡萄糖,故可作人类的营养物质
D.利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程
查看答案和解析>>
科目: 来源:2014届浙江省温州市十校联合体高三上学期期初联考化学试卷(解析版) 题型:选择题
下列化学用语正确的是 ( )
A.HCN分子的结构式:H-C≡N
B.乙烯的结构简式:CH2CH2
C.F-离子结构示意图:
D.二氧化碳的电子式:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com